Neuropilina
As neuropilinas (NRP) son proteínas receptoras que son activas nas neuronas.
| Neuropilina | |
|---|---|
 | |
| Identificadores | |
| Símbolo | NRP |
| InterPro | IPR014648 |
| Membranome | 16 |
| Identificadores | |
| Símbolo | NRP1 |
| Entrez | 8829 |
| HUGO | 8004 |
| OMIM | |
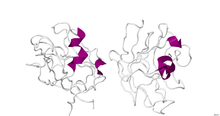
| PDB | 3I97 |
| RefSeq | NM_001024628 |
| UniProt | O14786 |
| Outros datos | |
| Locus | Cr. 10 p12 |
| Identificadores | |
| Símbolo | NRP2 |
| Entrez | 8828 |
| HUGO | 8005 |
| OMIM | |
| RefSeq | NM_201279 |
| UniProt | O60462 |
| Outros datos | |
| Locus | Cr. 2 q34 |
Existen dúas formas de neuropilinas no corpo humano, chamadas NRP-1 e NRP-2. As neuropilinas son glicoproteínas transmembrana, que se documentou primeiramente que regulaban a neuroxénese e a anxioxénese ao formaren complexos con receptores da plexina/semaforina de clase 3 e receptores de VEGF/VEGF, respectivamente.[2][3] As neuropilinas actúan predominantemente como correceptores, xa que teñen un dominio citoplasmático moi pequeno e así dependen de receptores da superficie celular para transducir os seus sinais a través da membrana plasmática.[2][3] Estudos recentes indicaron que as neuropilinas son multifuncionais e poden interaccionar cunha ampla variedade de receptores transmembrana. As neuropilinas están, por tanto, asociadas con numerosas vías de sinalización incluíndo as que son activadas polo factor de crecemento epidérmico (EGF), o factor de crecemento de fibroblastos (FGF), o factor de crecemento de hepatocitos (HGF), o factor de crecemento similar á insulina (IGF), o factor de crecemento derivado de plaquetas (PDGF) e o factor de crecemento transformante beta (TGFβ).[4][5] Aínda que as neuropilinas se atopan comunmente na superficie celular, tamén se informou da súa presenza dentro das mitocondrias e o núcleo.[6][7] Ambos os membros da familia da neuropilina poden encontrarse tamén en formas solubles creadas por empalme alternativo ou por desprendemento de ectodominio desde a superficie celular.[8][9]
A natureza pleiotrópica dos receptores NRP ten como resultado que estean implicados en diversos procesos celulares, como a guía de axóns e a anxioxénese, a resposta inmunitaria e a remielinización.[10] Por tanto, a desregulación da actividade das NRP foi asociada con moitas condicións patolóxicas, como moitos tipos de cancro e enfermidades cardiovasculares.[11][12][13][14]
Aplicacións
editarA neuropilina 1 é unha diana terapéutica no tratamento da leucemia e o linfoma, xa que se observou que hai un incremento da súa expresión nas liñas celulares de leucemia e linfoma.[15] Ademais, o antagonismo da neuropilina-1 inhibe a migración e adhesión de células tumorais.[16]
Estrutura
editarAs neuropilinas conteñen os seguintes catro dominios:
- Dominio CUB N-terminal (para o complemento C1r/C1s, Uegf, Bmp1)
- Dominio do factor de coagulación de tipo 5/8, C-terminal (dominio de discoidina)
- Dominio MAM (para a meprina, proteína A-5 e a proteína receptora tirosina foasfatase mu)
- Dominio C-terminal de neuropilina
A estrutura do dominio B1 da neuropilina 1 determinouse por difracción de raios x cunha resolución de 2,90 Å. A estrutura secundaria deste dominio é nun 5% en hélice alfa e nun 46% en folla beta.[1]
Gráfico de Ramachandran aquí:[17]
Notas
editar- ↑ 1,0 1,1 PDB 3I97; Jarvis A, Allerston CK, Jia H, Herzog B, Garza-Garcia A, Winfield N, et al. (marzo de 2010). "Small molecule inhibitors of the neuropilin-1 vascular endothelial growth factor A (VEGF-A) interaction". Journal of Medicinal Chemistry 53 (5): 2215–26. PMC 2841442. PMID 20151671. doi:10.1021/jm901755g.
- ↑ 2,0 2,1 Pellet-Many C, Frankel P, Jia H, Zachary I (abril de 2008). "Neuropilins: structure, function and role in disease". The Biochemical Journal 411 (2): 211–26. PMID 18363553. doi:10.1042/bj20071639.
- ↑ 3,0 3,1 Schwarz Q, Ruhrberg C (xaneiro de 2010). "Neuropilin, you gotta let me know: should I stay or should I go?". Cell Adhesion & Migration 4 (1): 61–6. PMC 2852559. PMID 20026901. doi:10.4161/cam.4.1.10207.
- ↑ Kofler N, Simons M (maio de 2016). "The expanding role of neuropilin: regulation of transforming growth factor-β and platelet-derived growth factor signaling in the vasculature". Current Opinion in Hematology 23 (3): 260–7. PMC 4957701. PMID 26849476. doi:10.1097/moh.0000000000000233.
- ↑ Roy S, Pramanik A, Chakraborti T, Chakraborti S (2017). "Multifaceted Role of Matrix Metalloproteases on Human Diseases". Proteases in Human Diseases (Springer Singapore): 21–40. ISBN 978-981-10-3161-8. doi:10.1007/978-981-10-3162-5_2.
- ↑ Issitt T, Bosseboeuf E, De Winter N, Dufton N, Gestri G, Senatore V, et al. (xaneiro de 2019). "Neuropilin-1 Controls Endothelial Homeostasis by Regulating Mitochondrial Function and Iron-Dependent Oxidative Stress". iScience 11: 205–223. PMC 6327076. PMID 30623799. doi:10.1016/j.isci.2018.12.005.
- ↑ Mehta V, Fields L, Evans IM, Yamaji M, Pellet-Many C, Jones T, et al. (agosto de 2018). "VEGF (Vascular Endothelial Growth Factor) Induces NRP1 (Neuropilin-1) Cleavage via ADAMs (a Disintegrin and Metalloproteinase) 9 and 10 to Generate Novel Carboxy-Terminal NRP1 Fragments That Regulate Angiogenic Signaling". Arteriosclerosis, Thrombosis, and Vascular Biology 38 (8): 1845–1858. PMC 6092111. PMID 29880492. doi:10.1161/ATVBAHA.118.311118.
- ↑ Rossignol M, Gagnon ML, Klagsbrun M (decembro de 2000). "Genomic organization of human neuropilin-1 and neuropilin-2 genes: identification and distribution of splice variants and soluble isoforms". Genomics 70 (2): 211–22. PMID 11112349. doi:10.1006/geno.2000.6381.
- ↑ Werneburg S, Buettner FF, Erben L, Mathews M, Neumann H, Mühlenhoff M, Hildebrandt H (agosto de 2016). "Polysialylation and lipopolysaccharide-induced shedding of E-selectin ligand-1 and neuropilin-2 by microglia and THP-1 macrophages". Glia 64 (8): 1314–30. PMID 27159043. doi:10.1002/glia.23004.
- ↑ Mecollari V, Nieuwenhuis B, Verhaagen J (2014). "A perspective on the role of class III semaphorin signaling in central nervous system trauma". Frontiers in Cellular Neuroscience 8: 328. PMC 4209881. PMID 25386118. doi:10.3389/fncel.2014.00328.
- ↑ Niland S, Eble JA (febreiro de 2019). "Neuropilins in the Context of Tumor Vasculature". International Journal of Molecular Sciences 20 (3): 639. PMC 6387129. PMID 30717262. doi:10.3390/ijms20030639.
- ↑ Kofler N, Simons M (maio de 2016). "The expanding role of neuropilin: regulation of transforming growth factor-β and platelet-derived growth factor signaling in the vasculature". Current Opinion in Hematology 23 (3): 260–7. PMC 4957701. PMID 26849476. doi:10.1097/MOH.0000000000000233.
- ↑ Pellet-Many C, Mehta V, Fields L, Mahmoud M, Lowe V, Evans I, et al. (novembro de 2015). "Neuropilins 1 and 2 mediate neointimal hyperplasia and re-endothelialization following arterial injury". Cardiovascular Research (Oxford University Press) 108 (2): 288–98. OCLC 927518632. PMC 4614691. PMID 26410366. doi:10.1093/cvr/cvv229.
- ↑ Harman, Jennifer L.; Sayers, Jacob; Chapman, Chey; Pellet-Many, Caroline (2020-07-21). "Emerging Roles for Neuropilin-2 in Cardiovascular Disease". International Journal of Molecular Sciences (en inglés) 21 (14): 5154. PMC 7404143. PMID 32708258. doi:10.3390/ijms21145154.
- ↑ Karjalainen K, Jaalouk DE, Bueso-Ramos CE, Zurita AJ, Kuniyasu A, Eckhardt BL, et al. (xaneiro de 2011). "Targeting neuropilin-1 in human leukemia and lymphoma". Blood 117 (3): 920–7. PMC 3298438. PMID 21063027. doi:10.1182/blood-2010-05-282921.
- ↑ Jia H, Cheng L, Tickner M, Bagherzadeh A, Selwood D, Zachary I (febreiro de 2010). "Neuropilin-1 antagonism in human carcinoma cells inhibits migration and enhances chemosensitivity". British Journal of Cancer 102 (3): 541–52. PMC 2822953. PMID 20087344. doi:10.1038/sj.bjc.6605539.
- ↑ "MolProbity Ramachandran analysis of PDB structure 3I97" (PDF). www.pdb.org. Arquivado dende o orixinal (PDF) o 23 de setembro de 2012. Consultado o 24 de abril de 2022.
Véxase tamén
editarLigazóns externas
editar- Neuropilins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.