Transesterificación
En química orgánica, a transesterificación é o proceso de intercambiar o grupo orgánico R″ dun éster co grupo orgánico R′ dun alcohol. Estas reaccións son a miúido catalizadas pola adición dun catalizador ácido ou base. A reacción pode tamén realizarse coa axuda de encimas (biocatalizadores) particularmente lipases (E.C.3.1.1.3).
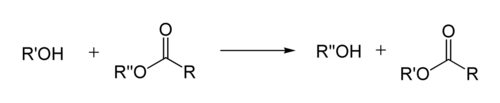
Os ácidos fortes catalizan a reacción doando un protón ao grupo carbonilo, o que o converte nun electrófilo máis potente, mentres que as bases catalizan a reacción ao retirar o protón do alcohol, facéndoo así máis nucleofílico. Os ésteres con grupos alcoxi máis grandes poden producirse a partir de metil ésteres ou etil ésteres con alta pureza ao quentar a mestura formada polo éster, ácido ou base, e un alcohol grande e evaporando o alcohol pequeno para equilibrar.
Mecanismo
editarNo mecanismo da transesterificación, o carbono carbonílico do éster inicial (RCOOR1) sofre un ataque nucleofílico do alcóxido entrante (R2O−) para dar un intermediario tetrahédrico, que ou ben reverte ao material inicial, ou ben orixina o produto transesterificado (RCOOR2). Estas varias especies existen en equilibrio, e a distribución do produto depende das enerxías relativas do reactivo e o produto.
Aplicacións
editarProdución de poliéster
editarA aplicación a grande escala da transesterificación é na síntese de poliésteres.[1] Nesta aplicación faise que diésteres sufran transesterificación con diois para formar macromoléculas. Por exemplo, o dimetil tereftalato e o etilenglicol reaccionan para formar polietileno tereftalato e metanol, o cal evapora para pular a reacción cara a adiante.
Metanólise e produción de biodiésel
editarA reacción inversa, chamada metanólise, é tamén un exemplo de transesterificación. Este proceso foi utilizado para reciclar poliésteres en monómeros separados (ver reciclaxe de plástico). Utilízase para converter graxas (triglicéridos) en biodiésel. Esta conversión foi un dos seus primeiros usos. O aceite vexetal transesterificado (biodiésel) xa foi utilizado como combustible para vehículos pesados en Suráfrica antes da segunda guerra mundial.
Foi patentada nos Estados Unidos na década de 1950 por Colgate, aínda que a transesterificación de biolípidos pode que se descubrira moito antes. Na década de 1940, os investigadores estaban a buscar un método para producir máis facilmente o glicerol, o cal se utilizaba para fabricar explosivos para usalos na segunda guerra mundial. Moitos dos métodos usados hoxe polos produtores teñen a súa orixe nas investigacións iniciais feitas na década de 1940.
Investigadores xaponeses demostraron recentemente que a transesterificación de biolípidos é posible facela utilizando unha metodoloxía de metanol supercrítico, na cal se utilizan altas temperaturas e presións para catalizar fisicamente a reacción biolípido/metanol en ácido graxo e metil ésteres.
Transesterificación a alta presión
editarA transesterificación catalizada por bases caracterízase por un volume de activación negativo (aproximadamente −12 cm3) e, por tanto, procede máis rapidamente en condicións de alta presión. Comprobouse que a alcohólise catalizada por amino de ésteres con impedimentos estéricos (por exemplo, grupos protectores, auxiliares quirais) procede rapidamente a temperatura moderada a unha presión de 10 kbar, dando rendementos cuantitativos.[2]
Notas
editar- ↑ Wilhelm Riemenschneider1 and Hermann M. Bolt "Esters, Organic" Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a09_565.pub2
- ↑ Romanski, J.; Nowak, P.; Kosinski, K.; Jurczak, J. (Sep 2012). "High-pressure transesterification of sterically hindered esters". Tetrahedron Lett. 53 (39): 5287–5289. doi:10.1016/j.tetlet.2012.07.094.