Beta-lactama
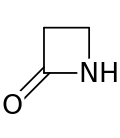
Unha beta-lactama (β-lactama) ou anel beta-lactámico é unha lactama que forma un anel de catro membros.[1] As lactamas son amidas cíclicas. A denominación beta do seu nome refírese a que o seu átomo de nitróxeno está unido ao átomo de carbono β en relación ao carbonilo. A β-lactama máis simple posible é a 2-azetidinona. Os aneis β-lactámicos forman parte da estrutura de importantes antibióticos, chamados antibióticos beta-lactámicos, como a penicilina. Algunhas bacterias son resistentes a eses antibióticos porque teñen un encima beta-lactamase, que rompe o anel β-lactámico.

Importancia clínica
editarO anel β-lactámico forma parte da estrutura central de varias familias de antibióticos, os principais son as penicilinas, cefalosporinas, carbapenems e monobactams, que son, por tanto, chamados tamén antibióticos β-lactámicos. Case todos estes antibióticos funcionan inhibindo a biosíntese da parede celular. Isto ten un efecto letal sobre as bacterias, aínda que toda poboación de bacterias adoita conter un subgrupo que é resistente a antibióticos β-lactámicos. A resistencia bacteriana só ocorre como resultado da expresión dun dos moitos xenes que existen do encima β-lactamase. Documentáronse máis de 1 800 encimas β-lactamases diferentes en varias especies de bacterias.[2] Estes encimas varían amplamente na súa estrutura química e eficiencia catalítica.[3] Cando as poboacións bacterianas teñen estes subgrupos resistentes, o tratamento con antibióticos β-lactámicos pode ter como resultado que a cepa resistente se faga máis frecuente e, por tanto, a especie sexa máis virulenta. Os antibióticos derivados da β-lactama poden considerarse como unha das clases de antibióticos máis importantes, pero tendente a presentar resistencia clínica. A β-lactama mostra as súas propiedades como antibiótico imitando o substrato natural D-Ala-D-Ala para o grupo de encimas chamados proteínas de unión á penicilina (PBP, do inglés penicillin binding proteins), que teñen como función establecer enlaces cruzados co peptidoglicano da parede celular bacteriana.[4]
Historia
editarA primeira β-lactama sintética preparouna Hermann Staudinger en 1907 ao facer reaccionar a base de Schiff da anilina e o benzaldehido coa difenilcetena[5][6] nunha cicloadición [2+2] (o Ph na figura indica un grupo funcional fenilo):
Ata 1970, a maioría das investigacións sobre as β-lactamas realizábanse cos grupos da penicilina e cefalosporina, pero desde entón, describíronse unha ampla variedade de estruturas.[7]
Síntese
editarA síntese Breckpot é a síntese de β-lactamas substituídas a partir da ciclación de ésteres de beta aminoácidos usando o reactivo de Grignard [2].
Reactividade
editarDebido á tensión de anel (ring strain), as β-lactamas son hidrolizadas máis doadamente que as amidas liñais ou lactamas máis grandes. Esta tensión increméntase máis pola fusión a un segundo anel, como se observa na maioría dos antibióticos β-lactámicos. Esta tendencia débese a que o carácter amida da β-lactama é reducido pola aplanaridade do sistema. O átomo de nitróxeno dunha amida ideal ten hibridación sp2 debido á resonancia, e os átomos con hibridación sp2 teñen xeometría de enlace planar trigonal. Como se forza unha xeometría de enlace piramidal no átomo de nitróxeno pola tensión de anel, a resonancia do enlace amida queda reducida, e o carbonilo compórtase de forma parecida a unha cetona. O premio Nobel Robert Burns Woodward describiu un parámetro h que mide a altura da pirámide trigonal definida polo nitróxeno (como o apex) e os seus tres átomos adxacentes. h corresponde á forza do enlace β-lactama e os valores máis baixos (máis planar; máis similar a unha amida ideal) son máis fortes e menos restritivos.[8] Os monobactams teñen valores h entre 0,05 e 0,10 ángstroms (Å). Os cefems teñen valores h de 0,20–0,25 Å. Os penams teñen valores entre 0,40 e 0,50 Å, mentres que os carbapenems e clavams teñen valores entre 0,50 e 0,60 Å, sendo as máis reactivas das β-lactamas en canto á hidrólise.[9]
Outras aplicacións
editarUn novo estudo suxeriu que as β-lactamas poden experimentar unha polimerización de apertura do anel para formar enlaces amida, e converterse en polímeros de nailon-3. Os esqueletos destes polímeros son idénticos aos dos péptidos, que lles dan biofuncionalidade. Estes polímeros de nailon-3 poden imitar a péptidos de defensa do hóspede.[10]
Tamén se informou de axentes antiproliferativos que actúan sobre a tubulina que teñen na súa estrutura β-lactamas.[11][12]
Notas
editar- ↑ Gilchrist, T. (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 0-582-01421-2.
- ↑ Brandt, C.; et al. (2017). "In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species". SciRep 7 (43232). Bibcode:2017NatSR...743232B. doi:10.1038/srep43232.
- ↑ Ehmann, David E.; et al. (2012). "Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor". PNAS 109 (29): 11663–11668. Bibcode:2012PNAS..10911663E. doi:10.1073/pnas.1205073109.
- ↑ Tipper, D. J.; Strominger, J. L. Proc. Natl. Acad. Sci. U.S.A. 1965, 54, 1133– 41[Crossref], [PubMed], [CAS]
- ↑ Tidwell, Thomas T. (2008). "Hugo (Ugo) Schiff, Schiff Bases, and a Century of β-Lactam Synthesis". Angewandte Chemie International Edition 47 (6): 1016–20. PMID 18022986. doi:10.1002/anie.200702965.
- ↑ Hermann Staudinger (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1-2): 51–123. doi:10.1002/jlac.19073560106.
- ↑ Flynn, E.H. (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press.
- ↑ Woodward, R.B. (1980). "Penems and related substances". Phil Trans Royal Soc Chem B 289 (1036): 239–50. Bibcode:1980RSPTB.289..239W. PMID 6109320. doi:10.1098/rstb.1980.0042.
- ↑ Nangia, A.; Biradha, K.; Desiraju, G.R. (1996). "Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study". J Chem Soc, Perkin Trans 2 (5): 943–53. doi:10.1039/p29960000943.
- ↑ Brendan P. Mowery, Alexandra H. Lindner, Bernard Weisblum‡, Shannon S. Stahl e Samuel H. Gellman. Structure−activity Relationships among Random Nylon-3 Copolymers That Mimic Antibacterial Host-Defense Peptides. J. Am. Chem. Soc., 2009, 131 (28), pp 9735–9745 DOI: 10.1021/ja901613g [1]
- ↑ O'Boyle, Niamh; Miriam Carr; Lisa Greene; Orla Bergin; Seema M. Nathwani; Thomas McCabe; David G. Lloyd; Daniela M. Zisterer; Mary J. Meegan (December 2010). "Synthesis and Evaluation of Azetidinone Analogues of Combretastatin A-4 as Tubulin Targeting Agents". Journal of Medicinal Chemistry 53 (24): 8569–8584. PMID 21080725. doi:10.1021/jm101115u.
- ↑ O'Boyle, Niamh; Lisa Greene; Orla Bergin; Jean-Baptiste Fichet; Thomas McCabe; David G. Lloyd; Daniela M Zisterer; Mary J. Meegan (2011). "Synthesis, evaluation and structural studies of antiproliferative tubulin-targeting azetidin-2-ones" (PDF). Bioorganic and Medicinal Chemistry 19 (7): 2306–2625. doi:10.1016/j.bmc.2011.02.022. hdl:2262/54923.