Anquirina
| |
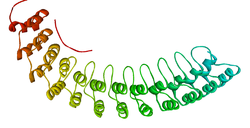
| Modelo dun fragmento do dominio de unión á membrana da anquirina R.[1] | |
| Identificadores | |
| Símbolo | ANK1 |
| Símbolos alt. | AnkyrinR, Band2.1 |
| Entrez | 286 |
| HUGO | 492 |
| OMIM | |
| PDB | 1N11 |
| RefSeq | NM_000037 |
| UniProt | P16157 |
| Outros datos | |
| Locus | Cr. 8 p21.1-11.2 |
Repeticións de anquirina
| |
| Identificadores | |
| Símbolo | Ank |
| Outros datos | |
| Identificadores | |
| Símbolo | ANK2 |
| Símbolos alt. | AnkyrinB |
| Entrez | 287 |
| HUGO | 493 |
| OMIM | |
| RefSeq | NM_001148 |
| UniProt | Q01484 |
| Outros datos | |
| Locus | Cr. 4 q25-q27 |
| Identificadores | |
| Símbolo | ANK3 |
| Símbolos alt. | AnkyrinG |
| Entrez | 288 |
| HUGO | 494 |
| OMIM | |
| RefSeq | NM_020987 |
| UniProt | Q12955 |
| Outros datos | |
| Locus | Cr. 10 q21 |
As anquirinas (da palabra grega que significa áncora; en inglés ankyrins[2] ) son unha familia de proteínas adaptadoras que median a unión de proteínas integrais de membrana ao citoesqueleto asociado á membrana baseado na espectrina-actina.[3] As anquirinas teñen sitios de unión para a subunidade beta da espectrina e para polo menos 12 familias de proteínas integrais de membrana. Esta unión é necesaria para manter a integridade da membrana plasmática e para ancorar canles iónicas específicos, intercambiadores iónicos e transportadores de ións na membrana plasmática.
Estrutura
editarAs anquirinas conteñen catro dominios estruturais: un dominio N-terminal que contén 24 repeticións de anquirina en tándem, un dominio central que se une á espectrina, un dominio de morte (celular) que se une a proteínas implicadas na apoptose, e un dominio C-terminal regulatorio que é moi variable entre os diferentes tipos de proteínas anquirina.[3]
Subtipos
editarAs anquirinas están codificadas por tres xenes (ANK1, ANK2 e ANK3) en mamíferos. Cada xene á súa vez produce múltiples proteínas por medio do splicing alternativo.
ANK1
editarO xene ANK1 codifica as proteínas anquirina-R. A anquirina-R foi caracterizada primeiro nos eritrocitos humanos, nos que esta anquirina se denominou anquirina do eritrocito ou banda 2.1.[4] A anquirina-R permite aos eritrocitos resistir as forzas de cizalla ás que están sometidos na circulación sanguínea. As persoas con anquirina-R reducida ou deficiente teñen unha forma de anemia hemolítica denominada esferocitose hereditaria.[5] Nos eritrocitos, a anquirina-R únese ao esqueleto da membrana polo intercambiador aniónico Cl-/HCO3-.[6]
A anquirina 1 lígase aos receptores de membrana CD44 polo receptor inositol trifosfato e o citoesqueleto.[7]
ANK2
editarPosteriormente, identificáronse as proteínas anquirina-B (produtos do xene ANK2[8]) no cerebro e músculo. A anquirina-B e a anquirina-G requírense para a distribución polarizada de moitas proteínas de membrana, como a ATPase Na+/K+, a canle de Na+ regulada por voltaxe e o intercambiador de Na+/Ca2+.
ANK3
editarAs proteínas anquirina-G (produtos do xene ANK3 [9]) identificáronse nas células epiteliais e neuronas. Unha análise xenética a grande escala realizada en 2008 mostrou a posibilidade de que a ANK3 estea implicada no trastorno bipolar.[10][11]
Notas
editar- ↑ 1N11en RCB Protein Data Bank referenciado tamén en Michaely P, Tomchick DR, Machius M, Anderson RG (2002). "Crystal structure of a 12 ANK repeat stack from human ankyrinR". EMBO J. 21 (23): 6387–96. PMC 136955. PMID 12456646. doi:10.1093/emboj/cdf651.
- ↑ MesH name Ankyrin
- ↑ 3,0 3,1 Bennett V, Baines AJ (1 July 2001). "Spectrin and ankyrin-based pathways: metazoan inventions for integrating cells into tissues". Physiol. Rev. 81 (3): 1353–92. PMID 11427698. Arquivado dende o orixinal o 13 de maio de 2010. Consultado o 10 de outubro de 2012.
- ↑ Bennett V, Stenbuck PJ (10 April 1979). "Identification and partial purification of ankyrin, the high affinity membrane attachment site for human erythrocyte spectrin". J Biol Chem 254 (7): 2533–41. PMID 372182.
- ↑ Lux SE, Tse WT, Menninger JC, John KM, Harris P, Shalev O, Chilcote RR, Marchesi SL, Watkins PC, Bennett V (1990). "Hereditary spherocytosis associated with deletion of human erythrocyte ankyrin gene on chromosome 8". Nature 345 (6277): 736–9. PMID 2141669. doi:10.1038/345736a0.
- ↑ Bennett V, Stenbuck PJ (1979). "The membrane attachment protein for spectrin is associated with band 3 in human erythrocyte membranes". Nature 280 (5722): 468–73. PMID 379653. doi:10.1038/280468a0.
- ↑ Singleton PA, Bourguignon LY (2004). "CD44 interaction with ankyrin and IP3 receptor in lipid rafts promotes hyaluronan-mediated Ca2+ signaling leading to nitric oxide production and endothelial cell adhesion and proliferation". Exp Cell Res 295 (1): 102–18. PMID 15051494. doi:10.1016/j.yexcr.2003.12.025.
- ↑ Schott JJ, Charpentier F, Peltier S; et al. (1995). "Mapping of a Gene for Long QT Syndrome to Chromosome 4q25-27". Am. J. Hum. Genet. 57 (5): 1114–22. PMC 1801360. PMID 7485162.
- ↑ Kapfhamer D, Miller DE, Lambert S, Bennett V, Glover TW, Burmeister M (1995). "Chromosomal localization of the ankyrinG gene (ANK3/Ank3) to human 10q21 and mouse 10". Genomics 27 (1): 189–91. PMID 7665168. doi:10.1006/geno.1995.1023.
- ↑ Ferreira MA, O'Donovan MC, Meng YA; et al. (2008). "Collaborative genome-wide association analysis supports a role for ANK3 and CACNA1C in bipolar disorder". Nat. Genet. 40 (9): 1056–8. PMC 2703780. PMID 18711365. doi:10.1038/ng.209.
- ↑ "Channeling Mental Illness: GWAS Links Ion Channels, Bipolar Disorder". Schizophrenia Research Forum: News. schizophreniaforum.org. 2008-08-19. Arquivado dende o orixinal o 18 de decembro de 2010. Consultado o 2008-08-21.
Véxase tamén
editarLigazóns externas
editar- Proteopedia|1n11 Ankyrin-R