ARN antisentido
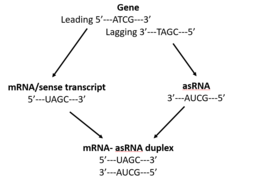
O ARN antisentido (ARNas ou asRNA), tamén denominado transcrito antisentido,[1] transcrito antisentido natural (NAT)[2][3][4] ou oligonucleótido antisentido,[5] é un ARN monocatenario que é complementario dun ARN mensaxeiro (que codifica unha proteína) co cal se hibrida, e dese modo bloquea a súa tradución a proteínas. O ARN antisentido aparece de forma natural tanto en procariotas coma eucariotas[1] e pertence a un subtipo de ARN non codificante longo (lncRNA) que ten unha lonxitude maior de 200 nucleótidos.[4] A función primaria dos ARN antisentido é regularen a expresión xénica. O ARN antisentido pode tamén producirse sinteticamente e ten un amplo uso como ferramenta de investigación nos experimentos de knockdown de xenes. Pode ter tamén aplicacións terapéuticas.[1][4][6]
Descubrimento e historia no desenvolvemento de fármacos editar
Algúns dos primeiros ARN antisentido descubríronse cando se investigaban proteínas funcionais. Un exemplo foi o ARNas micF. Cando se estaban caracterizando as porinas ompC da membrana externa de Escherichia coli, observouse que algúns dos clons de promotores de ompC podían reprimir a expresión doutras porinas de membrana como ompF. A rexión responsable desta represión da función atopouse que era un locus de 300 pares de bases situado augas arriba do promotor de ompC. Esta rexión de 300 pares de bases é un 70% homóloga en secuencia co extremo 5' do ARNm ompF, polo que o transcrito deste locus de 300 pares de bases era complementario do ARNm de ompF. Posteriormente, este transcrito, denominado micF, viuse que era un ARN antisentido de ompF e podía regular á baixa a expresión de ompF baixo estrés formando un dúplex co ARNm de ompF. Isto induce a degradación do ARNm de ompF.[2]
A diferenza do descubrimento accidental do ARN micF, a maioría dos ARN antisentido descubríronse por amplas buscas xenómicas de pequenos ARNm reguladores e por análise de transcriptoma. Convencionalmente, o primeiro paso implica as predicións computacionais baseadas nalgunhas características dos ARN antisentidos. Durante as buscas computacionais, as rexións codificantes están excluídas. As rexións que se predí que conservaron as súas estruturas de ARN e actúan como promotores orfos e terminadores independentes de Rho son as preferentes durante a análise. Como as buscas computacionais están centradas na rexión interxénica, os ARN antisentido que son transcritos a partir da febra oposta dun xene codificante probablemente van ser pasadas por alto por este método. Para detectar ARN antisentido transcrito a partir da rexión codificante, poden utilizarse micromatrices de oligonucleótidos. Nestes métodos, poden usarse como sondas unha ou as dúas febras de xenes codificantes. Ademais das buscas computacionais e as micromatrices, algúns ARN antisentido descubríronse secuenciando clons de ADNc e mapando elementos promotores.[7] Aínda que moitos descubrimentos feitos seguindo os enfoques mencionados antes deron lugar a moitos ARNas posibles, só uns poucos deles eran auténticos ARNas, como se comprobou en posteriores probas funcionais. Para minimizar o número de resultados falsos positivos, novos enfoque feitos en anos recentes centráronse na transcrición específica de febra, así como nos ARN non codificantes que se unen á cromatina e estudos dunha soa célula.[1]
A idea de que os ARN antisentido podían usarse como fármacos empezou a considerarse en 1978 cando Zamecnik e Stephenson encontraron que un oligonucleótido antisentido para o ARN viral do virus do sarcoma de Rous podía inhibir a replicación viral e a síntese de proteínas. Desde entón, dedicáronse moitos esforzos ao desenvolvemento de ARN antisentido candidatos a fármacos. En 1998, o primeiro ARNas fármaco, o fomivirsen, foi aprobado pola FDA estadounidense. O fomivirsen é un oligonucleótido de 21 pares de baseds, que foi desenvolvido para tratar a retinite por citomegalovirus en pacientes de SIDA. Funciona tomando como diana o ARNm transcrito do virus e en consecuencia inhibe a replicación do citomegalovirus. Malia que o fomivirsen deixou de producirse en 2004 debido á súa perda de mercado, serviu como exemplo exitoso e inspirador do uso de ARNas como dianas de fármacos ou fármacos candidatos.[5]
Outro exemplo de usar os ARN antisentido como axentes terapéuticos é o mipomersen, que foi aprobado pola FDA en 2013. O mipomersen foi desenvolvido para controlar o nivel de colesterol de lipoproteína de baixa densidade (LDL) en pacientes de hipercolesterolemia familiar homocigota, que é unha condición xenética dominante autosómica. Debido ao alto nivel de colesterol total (650–1000 mg/dL) e de receptor de LDL (por riba de 600 mg/dL) en dito tipo de hipercolesterolemia, os pacientes con esa doenza teñen un elevado risco de desenvolver enfermidades cardíacas coronarias. Como a proteína apoB-100 é necesaria para producir lipoproteína de densidade moi baixa (VLDL) e LDL, o mipomersen compleméntase co ARNm de apo-B-100 e márcao para a súa degradación dependente de RNAse H. Finalmente, o mipomersen pode reducir o nivel de LDL.[8]
Exemplos en distintas especies editar
Os ARN antisentido iniciais descubríronse en sistemas procariotas incluíndo plásmidos, bacteriófagos e bacterias. Por exemplo, no plásmido ColE1, o ARNas denominado ARN I desempeña un importante papel na determinación do número de copias de plásmido ao controlar a replicación. A replicación de ColE1 depende da transcrición dun ARN primer denominado ARN II. Unha vez que se transcribe o ARN II, hibrídase co seu molde de ADN e é posteriormente clivado pola RNase H. En presenza do ARNas ARN I, orixínase un dúplex entre o ARN I e o ARN II que introduce un cambio conformacional no ARN II. En consecuencia, o ARN II non pode hibridarse co seu molde de ADN, o que ten como resultado un baixo número de copias do plásmido ColE1. Noutro exemplo, no bacteriófago P22, o ARNas sar axuda a regular o paso de ciclo lítico a lisoxénico polo control da expresión de Ant.[9] Ademais de expresárense en procariotas, os ARNas foron tamén descubertos en plantas. O exemplo mellor descrito da regulación de ARNas en plantas é o do xene Locus de Floración C (FLC). O xene FLC en Arabidopsis thaliana codifica o factor de transcrición que impide a expresión dun conxunto de xenes que induce a transición floral. En ambientes fríos, o ARNas do xene FLC, denominado COOLAIR, é expresado e inhibe a expresión do FLC por medio da modificación da cromatina, o que permite a floración.[10] En células de mamíferos, un exemplo típico da regulación de ARNas é a inactivación do cromosoma X. O ARNas Xist pode recrutar o complexo represivo polycomb 2 (PRC2), que ten como resultado a heterocromatización do cromosoma X.[3]
Clasificación editar
Os ARN antisentido poden clasificarse de diferentes maneiras. En canto aos mecanismos reguladores, algúns autores agrupan os ARNas en interaccións ARN-ADN, interaccións ARN-ARN no núcleo ou no citoplasma e interaccións ARN-proteína (epixenética).[3] Os ARN antisentido poden ser categorizados polo tipo de promotores que inician a expresión dos ARNas: promotores independentes, promotores bidireccinais compartidos ou promotores crípticos. En canto á lonxitude, aínda que os ARNas en xeral clasifícanse como lncRNAs, hai tamén ARNas curtos dunha lonxitude de menos de 200 pares de bases. Como os mecanismos reguladores dun ARNas son específicos de especie, os ARNas poden tamén clasificarse por especie.[1] Un dos xeitos comúns de clasificar os ARNas é polo lugar onde se trancriben en relación cos seus xenes diana: os que actúan en cis (cis-acting) e os que actúan en trans (trans-acting).
Actuación en cis editar
Os ARNas que actúan en cis son transcritos a partir da febra oposta do xene diana no locus xénico diana. A miúdo mostran unha complementariedade de alto grao ou completa co xene diana. Se o ARNas que actúa en cis regula a expresión xénica ao ter como diana o ARNm, só pode unirse a un ARNm individual. Por medio de interaccións cos ARNm diana, os ARNas que actúan en cis poden bloquear a unión ao ribosoma ou recrutar a RNAase para degradar os ARNm diana. E consecuencia, a función destes ARNas que actúan en cis é reprimir a tradución dos ARNm diana.[2] Ademais dos ARNas que actúan en cis que teñen como diana ARNm, hai silenciadores epixenéticos que actúan en cis e activadores. En canto á modificación epixenética, a actuación en cis refírese á natureza destes ARNas que regulan cambios epixenéticos arredor dos loci onde son transcritos. En vez de unirse a ARNm individuais, estes reguladores epixenéticos que actúan en cis poden recrutar encimas modificadores da cromatina, que poden exercer efectos tanto na transcrición dos loci coma nos xenes veciños.[3]
Actuación en trans editar
Os ARNas que actúan en trans son transcritos a partir de loci que son distais con respecto aos xenes diana. En contraste cos ARNas que actúan en cis, mostran un baixo grao de complementariedade co xene diana, pero poden ser máis longos que os ARNas que actúan en cis. Poden tamén unirse a múltiples loci. Debido a estas propiedades dos ARNas que actúan en trans, forman complexos menos estables cos seus transcritos diana e ás veces requiren a axuda dunha proteína chaperona de ARN como Hfq para exerceren as súas funcións. Debido á complexidade dos ARNas que actúan en trans, son actualmente considerados como dianas menos "drogables".[2]
Función editar
Regulación epixenética editar
Hai moitos exemplos e ARN antisentido que mostran o efecto inhibidor sobre a iniciación da transcrición por medio de modificacións epixenéticas.
Metilación do ADN editar
A metilación do ADN pode orixinar unha regulación á baixa a longo prazo de xenes específicos. A represión de proteínas funcionais por medio da indución polo ARNas da metilación do ADN atopouse en varias doenzas humanas. Nunha clase de alfa-talasemia, un tipo de trastorno sanguíneo no que hai un nivel reducido de hemoglobina que causa unha insuficiencia de oxíxeno nos tecidos,[11] o xene da hemoglobina alfa 1 (HBA1) está regulado á baixa por un transcrito anormal dunha suposta proteína que se liga ao ARN similar a Luc7 (LUC71) que funciona como un ARN antisentido para HBA1 e induce a metilación do promotor de HBA1.[1] Outro exemplo é o silenciamento do xene supresor de tumores p15INK4b, tamén chamadao CDKN2B, na leucemia linfoblástica aguda e na leucemia mieloide aguda. O ARNas que é responsable deste efecto de silenciamento é un ARN antisentido non codificante do locus INK (ANRIL), que se expresa no mesmo locus que codifica o p15INK4b.[3]
Modificación de histonas editar
En células eucariotas, o ADN está estreitamente empaquetada con histonas. A modificación das histonas pode cambiar as interaccións co ADN, que poden inducir cambios na expresión xénica. As consecuencias biolóxicas da metilación de histonas dependen do contexto. En xeral, a metilación de histonas causa a represión de xenes pero a tamén poden orixinar a súa activación.[12] Hai probas de que a metilación de histonas pode ser inducida por ARNas. Por exemplo, o ANRIL, ademais da capacidade de inducir a metilación de ADN, pode tamén reprimir o xene veciño de CDKN2B, o CDKN2A, ao recrutar o complexo represivo polycomb 2 (PRC2), que causa a metilación de histonas (H3K27me). Outro exemplo clásico é a inactivación do cromosoma X por XIST.[1]
A modificación epixenética inducida por ANRIL é un exemplo de regulación epixenética que actúa en cis.[3] Ademais, a modificación da cromatina inducida por ARN antisentido pode actuar en trans. Por exemplo, en mamíferos, o ARNas HOTAIR é transcrito a partir do locus homeobox C (HOXC), pero recruta PRC2 en HOXD, que deposita H3K27 e silencia HOXD. HOTAIR é altamente expresado en tumores de mama primarios.[1]
Regulación cotranscricional editar
As regulacións epixenéticas como a metilación do ADN e a metilación de histonas poden reprimir a expresión xénica ao inhibiren a iniciacion da transcrición. Porén ás veces, a represión xénica pode conseguirse ao terminarse prematuramente ou ir máis lento o proceso de transcrición. Os ARN antisentido poden estar implicados neste nivel de regulación xénica. Por exemplo, en c]]élulas bacterianas ou eucariotas nos que están presentes ARN polimerases complexas, a transcrición bidireccional neste mesmo locus pode causar a colisión da polimerase e ter como resultado a terminación da transcrición. Mesmo cando a colisión da polimerase é improbable durante a transcrición débil, a pausa da polimerase pode tamén ocorrer, o cal bloquea a elongación e conduce á represión de xenes. Un dos exemplos é a represión do xene IME4 polo seu ARNas RME2. Outro modo de afectar a transcrición cotranscricionalmente é o bloqueo do empalme. Un exemplo clásico en humanos é o xene homeobox 2 que se une á E-box de dedo de cinc (ZEB2), que codifica a E-cadherina, un represor transcricional. Para a tradución eficiente do ARNm de ZEB2 cómpre a presenza dun sitio de entrada ao ribosoma interno (IRES) nun intrón do ARNm no extremo 5'. Cando se expresa o ARNas de ZEB2, este pode enmascarar o sitio de empalme e manter o IRES no ARNm, o cal ten como resultado unha síntese eficiente de E-cadherina. Finalmente, dependendo do nivel de expresión do ARNas, poden producirse diferentes isoformas do transcrito sentido. Por tanto, a regulación dependente de ARNas non está limitada a mecanismos de encendido/apagado, senón que presenta un sistema de control preciso do ton.[1]
Regulación postraducional editar
A modulación postranscricional directa por ARN antisentido consiste en que o ARNm é a diana directa do ARN antisentido; así, a tradución vaise ver afectada. Algunhas características deste tipo de ARNas describíronse nas seccións dos ARNas que actúan en cis e en trans. Este mecanismo é relativamente rápido porque tanto o ARNm diana coma o seu ARNas deben estar presentes simultaneamente na mesma célula. Como se describiu na sección da actuación en cis dos ARNas, o apareamento ARNm-ARNas pode ter como resultado o bloqueo da entrada ao ribosoma e a degradación dependente de RNase H. En conxunto, os ARNas que se unen a ARNm poden activar ou inhibir a tradución dos ARNm antisentido e os efectos inhibidores son os máis abundantes.[1]
Potencial terapéutico editar
Como elementos reguladores, os ARN antisentido posúen moitas vantaxes para ser considerados dianas de fármacos. En primeiro lugar, os ARNas regulan a expresión xénica a múltiples niveis incluíndo a transcrición, postranscrición e modificación epixenética. En segundo lugar, os ARNas que actúan en cis son específicos de secuencia e mostran un alto grao de complementariedade cos xenes diana.[1] En terceiro lugar, o nivel de expresión do ARNas é moi pequeno comparado co dos ARNm diana; por tanto, só son necesarias pequenas cantidades de ARNas para producir un efecto. Considerados como dianas de fármacos, isto representa unha gran vantaxe porque só cómpre unha baixa dose para conseguir unha efectividade.[4]
Nos últimos anos prestouse moita atención á idea de usar as propiedades dos ARNas para incrementar a expresión xénica nun locus de maneira específica. Debido á natureza do desenvolvemento de fármacos, sempre é máis fácil obter fármacos que funcionen como reguladores á baixa ou inhibidores que á alza ou activadores. Porén, existe a necesidade de crear fármacos que activen ou regulen á alza a expresión de xenes como os xenes supresores de tumores, factores de crecemento neuroprotectores e xenes que se encontran silenciados en certos trastornos mendelianos. Actualmente, a estratexia de restaurar a expresión xénica deficiente ou a función de proteínas defectuosa comprende terapias de substitución de encimas, terapias de microARN e introdución na célula de ADNc funcional. Porén, cada unha delas ten os seus inconvenientes. Por exemplo, a proteína sintetizada usada nas terapias de substitución de encimas a miúdo non pode imitar a función completa da proteína endóxena. Ademais, as terapias de substitución de encimas deben prolongarse durante toda a vida e teñen un custo económico moi elevado. Debido á natureza específica de locus dos ARN antisentido e as probas de cambios na expresión dos ARN antisentido en moitas doenzas, houbo intentos de deseñar oligonucleótidos monocatenarios, denominados antagoNATs, para inhibir os ARNas e finalmente incrementar a expresión de xenes específicos.[4]
Malia o prometedores que son os ARNas como candidatos a dianas de fármacos ou fármacos, aínda quedan algúns retos que hai que superar. O primeiro é que os ARNas e os antagoNATs poden ser degradados doadamente pola RNase ou outros encimas degradativos. Para impedir a degradación de oligonucleótidos terapéuticos, xeralmente cómpre que se introduza unha modificación química. A modificación química máis común nos oligonucleótidos é ligar un fosforotioato ao esqueleto da molécula.[5] Porén, a modificación con fosforotioato pode ser proinflamatoria. Observáronse efectos adversos como febre, calafríos ou náuseas despois de inxeccións locais de oligonucleótidos modificados con fosforotioato. En segundo lugar, a toxicidade fóra de diana tamén supón un gran problema. A pesar da natureza específica de locus dos ARN antisentido endóxenos, só do 10 ao 50% dos oligonucleótidos sintetizados mostraron o efecto sobre a diana agardado. Unha posible razón deste problema é a alta necesidade de que a estrutura do ARNas sexa recoñecida pola secuencia diana e a RNase H. Unha soa falta de concordancia na secuencia pode orixinar unha distorsión na estrutura secundaria e orixinar efectos fóra da diana buscada.[4] Finalmente, os ARNas artificiais teñen unha captación intracelular bastante limitada.[5] Aínda que as neuronas e as células da glía teñen a capacidade de captar libremente oligonucleótidos antisentido espidos, o ideal é usar portadores rastreables como virus e vesículas lipídicas para controlar e monitorizar as concentracións intracelulares e o metabolismo.[4]
Notas editar
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 Pelechano V, Steinmetz LM (December 2013). "Gene regulation by antisense transcription". Nature Reviews Genetics 14 (12): 880–93. PMID 24217315. doi:10.1038/nrg3594.
- ↑ 2,0 2,1 2,2 2,3 Saberi F, Kamali M, Najafi A, Yazdanparast A, Moghaddam MM (2016-07-28). "Natural antisense RNAs as mRNA regulatory elements in bacteria: a review on function and applications". Cellular & Molecular Biology Letters 21: 6. PMC 5415839. PMID 28536609. doi:10.1186/s11658-016-0007-z.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Magistri M, Faghihi MA, St Laurent G, Wahlestedt C (August 2012). "Regulation of chromatin structure by long noncoding RNAs: focus on natural antisense transcripts". Trends in Genetics 28 (8): 389–96. PMC 3768148. PMID 22541732. doi:10.1016/j.tig.2012.03.013.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Wahlestedt C (June 2013). "Targeting long non-coding RNA to therapeutically upregulate gene expression". Nature Reviews. Drug Discovery 12 (6): 433–46. PMID 23722346. doi:10.1038/nrd4018.
- ↑ 5,0 5,1 5,2 5,3 Kole R, Krainer AR, Altman S (January 2012). "RNA therapeutics: beyond RNA interference and antisense oligonucleotides". Nature Reviews. Drug Discovery 11 (2): 125–40. PMC 4743652. PMID 22262036. doi:10.1038/nrd3625.
- ↑ Weiss, B; Davidkova, G; Zhou, LW (March 1999). "Antisense RNA gene therapy for studying and modulating biological processes.". Cellular and molecular life sciences : CMLS. 55 (3): 334–58. doi:10.1007/s000180050296. PMID 10228554.
- ↑ Thomason MK, Storz G (2010). "Bacterial antisense RNAs: how many are there, and what are they doing?". Annual Review of Genetics 44 (1): 167–88. PMC 3030471. PMID 20707673. doi:10.1146/annurev-genet-102209-163523.
- ↑ Wong E, Goldberg T (February 2014). "Mipomersen (kynamro): a novel antisense oligonucleotide inhibitor for the management of homozygous familial hypercholesterolemia". P & T 39 (2): 119–22. PMC 3956393. PMID 24669178.
- ↑ Simons RW (1988). "Naturally occurring antisense RNA control--a brief review". Gene 72 (1–2): 35–44. PMID 2468573. doi:10.1016/0378-1119(88)90125-4.
- ↑ Ietswaart R, Wu Z, Dean C (September 2012). "Flowering time control: another window to the connection between antisense RNA and chromatin". Trends in Genetics 28 (9): 445–53. PMID 22785023. doi:10.1016/j.tig.2012.06.002.
- ↑ "alpha thalassemia". Genetics Home Reference. NIH U.S. National Library of Medicine. 14 November 2017.
- ↑ Whetstine JR. "Histone Methylation". Handbook of Cell Signaling (Second ed.). pp. 2389–2397. ISBN 978-0-12-374148-6. doi:10.1016/b978-0-12-374145-5.00287-4.