Ácido malónico
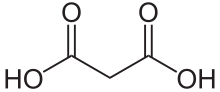
O ácido malónico ou ácido propanodioico é un ácido dicarboxílico de 3 carbonos coa fórmula CH2(COOH)2 [1]. O nome procede do grego μᾶλον (malon), que significa "mazá".
Número CAS: 141-82-2 .
O ácido malónico ten un esqueleto de 3 carbonos con dous grupos carboxilo (COOH), un en cada extremo da molécula, polo que é un ácido dicarboxílico. Os seus pKa son: pKa1=2,83, pKa2=5,69. Ten unha densidade de 1,619 g/cm3 e un punto de fusión de 135-136 °C.
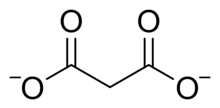
A súa forma ionizada e os seus ésteres e sales denomínanse malonatos. O ión malonato ten os seus dous grupos carboxilo ionizados. Entre os malonatos destacaremos os seguintes:
- dietil malonato, (C2H5)2(C3H2O4),
- dimetil malonato, (CH3)2(C3H2O4),
- disodio malonato, Na2(C3H2O4).
Bioquímica
editarO sal de calcio do ácido malónico aparece en altas concentracións na remolacha. Existe no seu estado normal en forma de cristais brancos. O ácido malónico é o clásico exemplo de inhibidor competitivo: Actúa sobre a succinato deshidroxenase (complexo II) na cadea de transporte electrónico, competindo co succinato [2][3]. Algúns derivados do ácido malónico son importantes no metabolismo, como o seu tioéster malonil-CoA, que é importante no metabolismo de lípidos.
Obtención
editarA preparación clásica do ácido malónico comeza a partir do ácido cloroacético:[4]
O carbonato de sodio xera o sal sódico, que despois reacciona co cianuro de sodio para producir o sal do ácido cianoacético por medio dunha substitución nucleofílica. O grupo nitrilo pode hidrolizarse con hidróxido de sodio para dar malonato sódico, e coa acidificación do medio obtense o ácido malónico.
Reaccións orgánicas
editarO ácido malónico condensase coa urea formando o ácido barbitúrico. O ácido malónico utilízase con frecuencia como enolato na condensación Knoevenagel ou condénsase con acetona para formar o ácido de Meldrum. Os ésteres do ácido malónico utilízanse tamén como -CH2COOH sinton na síntese de éster malónico.
Notas
editar- ↑ PubChem compound Malonic acid
- ↑ Potter, V. R.; Dubois, K. P. (1943). "Studies on the Mechanism of Hydrogen Transport in Animal Tissues : Vi. Inhibitor Studies with Succinic Dehydrogenase". The Journal of general physiology 26 (4): 391–404. PMC 2142566. PMID 19873352. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=2142566.
- ↑ Dervartanian DV, Veeger C. (1964). "Studies on succinate dehydrogenase. I. Spectral properties of the purified enzyme and formation of enzyme-competitive inhibitor complexes". Biochim. Biophys. Acta 92: 233–47. PMID 14249115.
- ↑ Organic Synthesis. Malonic acid. Nathan Weiner. collvol 2. Páxina 376. prep= cv2p0376 [1] Arquivado 14 de xuño de 2012 en Wayback Machine.
Ligazóns externas
editar- pH-Spectrum of Disodium Malonate Arquivado 28 de xaneiro de 2012 en Wayback Machine.
- pH-Spectrum of Malonate-copper-complex Arquivado 13 de marzo de 2016 en Wayback Machine.
- Calculator: Water and solute activities in aqueous malonic acid