Corpo de Barr
O corpo de Barr, corpúsculo de Barr, cromatina de Barr ou cromatina sexual é o corpúsculo formado polo cromosoma X inactivo que se encontra nas células somáticas das femias,[1] que se fixo inactivo por un proceso chamado lyonización, nas especies que, como a humana, determinan o sexo polo sistema XY ou as que, como as aves, fano polo ZW. Recibe o seu nome do seu descubridor Murray Barr [2]. A hipótese de Lyon (de onde vén o termo lyonización) afirma que nas células de mamíferos con varios cromosomas X, todos menos un son inactivados durante a embrioxénese.[3] Isto ocorre ao chou no desenvolvemento embrionario inicial dos mamíferos (pode inactivarse o X de orixe materna ou paterna),[4] agás en marsupiais e nalgúns tecidos extraembrionarios dalgúns mamíferos placentarios, nos cales é o cromosoma X paterno o que sempre se desactiva.[5]

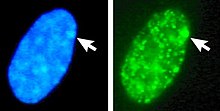
En homes e mulleres que teñen máis cromosomas X do normal, o número de corpos de Barr visibles na interfase é sempre un menos có número total de cromosomas X. Por exemplo, os homes cun cariotipo 47,XXY teñen un só corpo de Barr, e as mulleres co cariotipo 47,XXX teñen dous corpos de Barr.
Os corpos de Barr poden verse moi ben no núcleo dos neutrófilos, onde están nunha estrutura denominada pau de tambor.
Mecanismo
editarUnha muller normal ten só un corpo de Barr en cada célula somática, e un home normal non ten ningún.
A inactivación do cromosoma X de mamíferos iníciase a partir do centro de inactivación X ou Xic, xeralmente situado preto do centrómero.[6] O centro contén doce xenes, sete dos cales codifican proteínas, cinco orixinan ARN que non será traducido, dos cales só dous se sabe que xogan un papel activo no proceso de inactivación X, o Xist e o Tsix.[6] Este centro tamén parece ser importante na contaxe dos cromosomas: asegura que a inactivación ao chou só terá lugar cando están presentes dous ou máis cromosomas X. A provisión dun Xic extra artificial na embrioxénese temperá pode inducir a inactivación do único cromosoma X que teñen as células dos machos.[6]
Os papeis do Xist e Tsix parecen ser antagónicos. A perda da expresión do Tsix no futuro cromosoma X inactivo dá lugar a un incremento dos niveis de Xist arredor do Xic. Mentres, no futuro cromosoma X activo mantéñense os niveis de Tsix; e dese xeito os niveis de Xist permanecen baixos.[7] Este cambio permite ao ARN do Xist empezar a cubrir o futuro cromosoma inactivo, estendéndose desde o Xic.[8] Na inactivación non aleatoria esta elección do cromosoma parece estar fixada e as evidencias correntes suxiren que o xene herdado da nai pode experimentar "impronta xenética".[4]
Pénsase que este é o mecanismo para a selección do cromosoma a inactivar, e permite que procesos ulteriores establezan o estado compacto que presenta o corpo de Barr. Estes cambios inclúen modificacións de histonas, como a metilación das histonas H3 [9] e a ubiquitinación das histonas H2A,[10] xunto con modificacións directas do propio ADN, por metilación dos sitios CpG.[11] Estes cambios axudan a inactivar a expresión de xenes no cromosoma X inactivo e a causar a súa compactación para formar o corpo de Barr.
Notas
editar- ↑ Lyon, M. F., (2003), The Lyon and the LINE hypothesis. j.semcdb 14, 313-318. (Abstract)
- ↑ Barr, M. L., Bertram, E. G., (1949), A Morphological Distinction between Neurones of the Male and Female, and the Behaviour of the Nucleolar Satellite during Accelerated Nucleoprotein Synthesis. Nature. 163 (4148): 676-7.
- ↑ Lyon, M. F. (1961), Gene Action in the X-chromosome of the Mouse (Mus musculus L.) Nature. 190 (4773): 372-3. doi 10.1038/190372a0 PMID 13764598 (Abstract)
- ↑ 4,0 4,1 Brown,C.J., Robinson,W.P., (1997), XIST Expression and X-Chromosome Inactivation in Human Preimplantation Embryos. Am. J. Hum. Genet. 61, 5-8 (Full Text PDF)
- ↑ Lee, J. T., (2003), X-chromosome inactivation: a multi-disciplinary approach. j.semcdb 14, 311-312. (doi:10.1016/j.semcdb.2003.09.025 Abstract)
- ↑ 6,0 6,1 6,2 Rougeulle, C., Avner, P. (2003), Controlling X-inactivation in mammals: what does the centre hold?. j.semcdb 14, 331-340. (Abstract)
- ↑ Lee, J. T., Davidow, L. S., Warshawsky, D., (1999), Tisx, a gene antisense to Xist at the X-inactivation centre. Nat. Genet. 21, 400-404. Full Text
- ↑ Lyon, M. F., (2003), The Lyon and the LINE hypothesis. j.semcdb 14, 313-318. (Abstract
- ↑ Heard, E., Rougeulle, C., Arnaud, D., Avner, P., Allis, C. D. (2001), Methylation of Histone H3 at Lys-9 Is an Early Mark on the X Chromosome during X Inactivation. Cell 107, 727-738. (Full Text)
- ↑ de Napoles,M., Mermoud,J.E., Wakao,R., Tang,Y.A., Endoh,M., Appanah,R., Nesterova,T.B., Silva,J., Otte,A.P., Vidal,M., Koseki,H., Brockdorff,N., (2004), Polycomb Group Proteins Ring1A/B Link Ubiquitylation of Histone H2A to Heritable Gene Silencing and X Inactivation. Dev. Cell 7, 663-676 (Abstract)
- ↑ Chadwick,B.P., Willard,H.F., (2003), Barring gene expression after XIST: maintaining faculative heterochromatin on the inactive X. j.semcdb 14, 359-367 (Abstract)
Véxase tamén
editarOutros artigos
editarBibliografía
editar- Alberts,B., Johnson,A., Lewis,J., Raff,M., Roberts,K., Walter,P., (2002), Molecular Biology of the Cell, Fourth Edition, (428-429) Garland Science, 0-8153-4072-9 (Web Edition, Free access)
- Turnpenny & Ellard: Emery's Elements of Medical Genetics 13E (http://www.studentconsult.com/content/default.cfm?ISBN=9780702029172&ID=HC006029 Arquivado 13 de abril de 2020 en Wayback Machine.)