Cofactor F430
F430 é o cofactor (ás veces chamado coencima) do encima metil coencima M redutase (MCR).[1][2] A MCR cataliza a reacción EC 2.8.4.1 que libera metano no paso final da metanoxénese:
| Cofactor F430 | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 73145-13-8 |
| PubChem | 5460020 |
| ChemSpider | 21864910 |
| ChEBI | CHEBI:28265 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C 42H 51N 6NiO− 13 |
| Masa molecular | 906.58014 |
| Aspecto | sólido amarelo |
| Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
 |
 |
Só se encontra en arqueas metanóxenas[3] e en arqueas metanotróficas anaerobias. Aparece en concentracións relativamente altas en arqueas que están implicadas na metanoxénese inversa: estas poden conter ata un 7% do peso en proteína con níquel.[4]
Estrutura
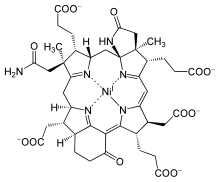
editarEn 1978 asignóuselle o nome trivial cofactor F430 baseándose nas propiedades dunha mostra amarela extraída de Methanobacterium thermoautotrophicum, que tiña un máximo espectroscópico a 430 nm.[5] Foi identificado como cofactor da MCR en 1982[6] e a estrutura completa deduciuse por cristalografía de raios X e espectroscopia RMN.[7] O coencima F430 presenta unha porfirina reducida nun sistema de aneis macrocíclico chamado corfina.[8] Ademais, posúe dous aneis adicionais en comparación co tetrapirrol estándar (aneis A-D), ten un anel E γ-lactámico e un anel F carbocíclico que contén un grupo ceto. É o único composto tetrapirrólico natural que contén níquel, un elemento que raramentese atopa en sistemas biolóxicos.[9]
Biosíntese
editarA biosíntese empeza co uroporfirinóxeno III, o proxenitor de todos os tetrapirrois naturais, incluíndo a clorofila, vitamina B12, ficobilinas, sirohemo, hemo e hemo d1. É convertido en sirohidroclorina a través da dihidrosirohidroclorina.[10] A inserción do níquel no tetrapirrol é catalizada na reacción EC 4.99.1.11 pola mesma quelatase, CbiX, que insire cobalto na biosíntese de cobalamina, dando lugar a níquel(II)-sirohidroclorina.[11]
A Ni-sirohidroclorina a,c-diamida sintase dependente de ATP (CfbE) converte despois as cadeas laterias a e c de acetato en acetamida en reaccións EC 6.3.5.12, xerando níquel(II)-sirohidroclorina a,c-diamida. A secuencia das dúas amidacións é aleatoria.[11] Un complexo de dous compoñentes Ni-sirohidroclorina a,c-diamida redutiva ciclase (CfbCD) leva a cabo unha redución de 6 electróns e 7 protóns do sistema de aneis nunha reacción EC 6.3.3.7 xerando o intermediario 15,173-seco-F430-173-ácido (seco-F430). A redución implica a hidrólise do ATP e os electróns pasan por dous centros 4Fe-4S. No paso final, o anel carboxilico F que contén ceto está formado por un encima coencima F(430) sintetase dependente de ATP (CfbB) na reacción EC 6.4.1.9, xerando o coencima F430.[11][12][13] Este encima é un ligase de tipo MurF, atopada na biosíntese de peptidoglicanos.
Notas
editar- ↑ Stephen W., Ragdale (2014). "Chapter 6. Biochemistry of Methyl-Coenzyme M Reductase: The Nickel Metalloenzyme that Catalyzes the Final Step in Synthesis and the First Step in Anaerobic Oxidation of the Greenhouse Gas Methane". En Peter M.H. Kroneck and Martha E. Sosa Torres. The Metal-Driven Biogeochemistry of Gaseous Compounds in the Environment. Metal Ions in Life Sciences 14. Springer. pp. 125–145. ISBN 978-94-017-9268-4. PMID 25416393. doi:10.1007/978-94-017-9269-1_6.
- ↑ Hofer, Ursula (2016). "Masters of methane". Nature Reviews Microbiology 14 (12): 727. PMID 27818502. doi:10.1038/nrmicro.2016.170.
- ↑ Thauer RK (1998). "Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson". Microbiology 144 (9): 2377–2406. PMID 9782487. doi:10.1099/00221287-144-9-2377. Arquivado dende o orixinal o 2020-05-17. Consultado o 2011-10-01.
- ↑ Krüger M, Meyerdierks A, Glöckner FO, et al. (decembro de 2003). "A conspicuous nickel protein in microbial mats that oxidize methane anaerobically". Nature 426 (6968): 878–81. Bibcode:2003Natur.426..878K. PMID 14685246. doi:10.1038/nature02207.
- ↑ Gunsalus, R.P.; Wolfe, R.S. (1978). "Chromophoric factors F342 and F430 of Methanobacterium thermoautotrophicum". FEMS Microbiology Letters 3 (4): 191–193. doi:10.1111/j.1574-6968.1978.tb01916.x.
- ↑ Ellefson, W. L.; Whitman, W. B.; Wolfe, R. S. (1982). "Nickel-containing factor F430: Chromophore of the methylreductase of Methanobacterium". Proceedings of the National Academy of Sciences 79 (12): 3707–3710. Bibcode:1982PNAS...79.3707E. PMC 346495. PMID 6954513. doi:10.1073/pnas.79.12.3707.
- ↑ Färber G, Keller W, Kratky C, Jaun B, Pfaltz A, Spinner C, Kobelt A, Eschenmoser A (1991). "Coenzyme F430 from Methanogenic Bacteria : Complete Assignment of Configuration Based on an X-ray Analysis of 12,13-diepi-F430 Pentamethyl Ester and on NMR Spectroscopy". Helvetica Chimica Acta 74 (4): 697–716. doi:10.1002/hlca.19910740404.
- ↑ Eschenmoser, A. (1986). "Chemistry of Corphinoids". Annals of the New York Academy of Sciences 471 (1 International): 108–129. Bibcode:1986NYASA.471..108E. doi:10.1111/j.1749-6632.1986.tb48030.x.
- ↑ Johnson, Michael K.; Scott, Robert A. (2 de outubro de 2017). Metalloprotein Active Site Assembly. ISBN 9781119159834.
- ↑ Mucha, Helmut; Keller, Eberhard; Weber, Hans; Lingens, Franz; Trösch, Walter (1985-10-07). "Sirohydrochlorin, a precursor of factor F430 biosynthesis in Methanobacterium thermoautotrophicum". FEBS Letters 190 (1): 169–171. doi:10.1016/0014-5793(85)80451-8.
- ↑ 11,0 11,1 11,2 Moore, Simon J.; Sowa, Sven T.; Schuchardt, Christopher; Deery, Evelyne; Lawrence, Andrew D.; Ramos, José Vazquez; Billig, Susan; Birkemeyer, Claudia; Chivers, Peter T.; Howard, Mark J.; Rigby, Stephen E. J.; Layer, Gunhild; Warren, Martin J. (2017). "Elucidation of the biosynthesis of the methane catalyst coenzyme F430". Nature 543 (7643): 78–82. Bibcode:2017Natur.543...78M. PMC 5337119. PMID 28225763. doi:10.1038/nature21427.
- ↑ Zheng, Kaiyuan; Ngo, Phong D.; Owens, Victoria L.; Yang, Xue-Peng; Mansoorabadi, Steven O. (2016). "The biosynthetic pathway of coenzyme F430 in methanogenic and methanotrophic archaea". Science 354 (6310): 339–342. Bibcode:2016Sci...354..339Z. PMID 27846569. doi:10.1126/science.aag2947.
- ↑ R. Caspi (2017-01-09). "Pathway: factor 430 biosynthesis". MetaCyc Metabolic Pathway Database. Consultado o 2020-04-27.