Cadea lixeira das inmunoglobulinas
A cadea lixeira das inmunoglobulinas é a subunidade polipeptídica pequena dun anticorpo (inmunoglobulina), que se encontra nos brazos da molécula con forma de Y dos anticorpos.
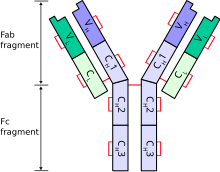
Un anticorpo típico está composto de dúas cadeas pesadas de Ig e dúas cadeas lixeiras.
En humanos
editarHai dous tipos de cadeas lixeiras en humanos:
- Cadea kappa (κ), codificada no locus kappa de inmunoglobulina (IGK@) situado no cromosoma 2.
- Cadea lambda (λ), codificada polo locus lambda de inmunoglobulina (IGL@) situado no cromosoma 22
Os anticorpos prodúcenos os linfocitos B, cada un dos cales expresa só unha clase de cadea lixeira nos seus anticorpos. Unha vez establecido o tipo de cadeda lixeira, esta permanece fixa durante toda a vida do linfocito B. Nun individuo san, a proporción kappa a lambda total é de aproximadamente 2:1 no soro (medindo anticorpos intactos completos) ou 1:1,5 se medimos as cadeas lixeiras libres, e unha proporción moi diverxente é indicativa de neoplasma.
A proporción normal exacta kappa a lambda, segundo un novo ensaio de cadeas lixeiras libres policlonais, vai de 0,26 a 1,65.[1] Tanto as cadeas kappa coma as lambda poden incrementarse ambas proporcionalmente, mantendo unha proporción normal. Isto é normalmente indicativo dalgunha outra cousa distinta dunha discrasia de células sanguíneas, como unha doenza renal.
Noutros animais
editarOs xenes das cadeas lixeiras das inmunoglobulinas en tetrápodos poden clasificarse en tres grupos: kappa (κ), lambda (λ) e sigma (σ). A diverxencia dos isotipos κ, λ e σ precedeu a radiación dos tetrápodos. O isotipo σ perdeuse despois da evolución da liñaxe dos anfibios e antes da diverxencia da liñaxe reptiliana.[2]
Outros tipos de cadeas lixeiras poden encontrarse en vertebrados inferiores, como a cadea lixeira de Ig iota de condrictios e teleoósteos.[3][4]
Os camélidos son únicos entre os mamíferos, xa que teñen tamén anticorpos completamente funcionais con dúas cadeas pesadas, pero carecen de cadeas lixeiras.[5]
Os tiburóns tamén posúen, como parte do seu sistema inmunitario adaptativo, unha molécula similar a un anticorpo homodímero de cadea pesada homodímera denominada IgNAR (receptor de antíxeno novo de inmunoglobulina). Crese que os IgNAR nunca estiveron asociados a unha cadea lixeira, ao contrario do que se pensa que pasou nos camélidos, nos que se cre que os seus anticorpos de só cadea pesada perderon a cadea lixeira durante a evolución.[6][7]
Estrutura
editarNun anticorpo típico só hai un tipo de cadea lixeira, así as dúas cadeas lixeiras dun anticorpo individual son idénticas.
Cada cadea lixeira está composta por dous dominios de inmunogloblina en tándem:
- Un dominio constante (CL). A rexión constante determina cal é a clase de cadea lixeira (kappa ou lambda).[8].
- Un dominio variable (VL), que é esencial para a unión ao antíxeno.
A lonxitude aproximada dunha cadea lixeira é de 211 a 217 aminoácidos.[3] A clase lambda ten 4 subtipos ( 1, 2, 3 e 4).[8]
En patoloxía
editarAs células B individuais no tecido linfoide posúen cadeas lixeiras kappa ou lambda, pero nunca ambas as dúas á vez. O rearranxo específico da cadea lixeira lambda das inmunoglobulinas pode orixinar nalgúns casos a perda dalgúns xenes codificantes de proteínas, que non parecen ser funcionalmente relevantes (mentres que pode sobreexresarse miR-650 funcionalmente relevante).[9] Usando inmunohistoquímica, é posible determinar a abundancia relativa de células B que expresan cadeas lixeiras kappa e lambda. Se o ganglio linfático ou tecido similar é reactivo, ou benigno, debería posuír unha mestura de células kappa positivas e lambda positivas. Porén, se un tipo de cadea lixeira é significativamente máis común que o outro, as células probablemente derivan todas dunha pequena poboación clonal, o que pode indicar unha condición maligna, como o linfoma de célula B.[10]
Se as cadeas lixeiras de Ig producidas en células plasmáticas neoplásticas, como as de mieloma múltiple, denomínanse proteínas de Bence Jones.
O incremento dos niveis de cadeas lixeiras de Ig libres tamén foi detectado en varias doenzas inflamatorias. É importante salientar que, a diferenza do aumento de nivel en pacientes de linfoma, estas cadeas lixeiras de Ig son policlonais. Recentes estudos mostraron que estas cadeas lixeiras de Ig poden unirse a mastocitos e, usando a súa capacidade de unirse a antíxenos, facilitan a activación destes mastocitos.[11] A activación dos mastocitos ten como resultado a liberación de varios mediadores proinflamatorios, que se cre contribúen ao desenvolvemento da doenza inflamatoria. Estudos recentes mostraron que as cadeas lixeiras de Ig non só activan os mastocitos senón tamén os ganglios da raíz dorsal[12] e neutrófilos,[13] expandindo o seu posible papel como mediadores da doenza inflamatoria.
Notas
editar- ↑ Katzmann JA, Clark RJ, Abraham RS, Bryant S, Lymp JF, Bradwell AR, Kyle RA (2001). "Serum reference intervals and diagnostic ranges for free kappa and free lambda immunoglobulin light chains: relative sensitivity for detection of monoclonal light chains". Clin Chem 48 (9): 1437–44. PMID 12194920.
- ↑ Das S, Nikolaidis N, Klein J, Nei M (2008). "Evolutionary redefinition of immunoglobulin light chain isotypes in tetrapods using molecular markers". Proc Natl Acad Sci U S A 105 (43): 16647–52. PMC 2575474. PMID 18940927. doi:10.1073/pnas.0808800105.
- ↑ 3,0 3,1 Janeway CA, Jr.; et al. (2001). Immunobiology. (5th ed.). Garland Publishing. (electronic full text via NCBI Bookshelf) ISBN 0-8153-3642-X.
- ↑ IMGT Index Arquivado 27 de abril de 2007 en Wayback Machine. Antibodies (or Immunoglobulins).
- ↑ Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa E, Bendahman N, Hamers R (1993). "Naturally occurring antibodies devoid of light chains". Nature 363 (6428): 446–8. PMID 8502296. doi:10.1038/363446a0.
- ↑ "A Case Of Convergence: Why Did a Simple Alternative to Canonical Antibodies Arise in Sharks and Camels?". PLOS. PMC 3149040. doi:10.1371/journal.pbio.1001120. Consultado o 4 October 2017.
- ↑ Greenberg, A. S.; Avila, D.; Hughes, M.; Hughes, A.; McKinney, E. C.; Flajnik, M. F. (1995-03-09). "A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks". Nature 374 (6518): 168–173. ISSN 0028-0836. PMID 7877689. doi:10.1038/374168a0.
- ↑ 8,0 8,1 Owen, Judith A.; Punt, Jenni; Stranford, Sharon (2013). Kuby Immunology. New York, NY: W. H. Freeman and Company. pp. 85. ISBN 9781429219198.
- ↑ Mraz, M.; Stano Kozubik, K.; Plevova, K.; Musilova, K.; Tichy, B.; Borsky, M.; Kuglik, P.; Doubek, M.; Brychtova, Y.; Mayer, J.; Pospisilova, S. (2013). "The origin of deletion 22q11 in chronic lymphocytic leukemia is related to the rearrangement of immunoglobulin lambda light chain locus". Leukemia Research 37 (7): 802–808. PMID 23608880. doi:10.1016/j.leukres.2013.03.018.
- ↑ Leong, Anthony S-Y; Cooper, Kumarason; Leong, F Joel W-M (2003). Manual of Diagnostic Cytology (2 ed.). Greenwich Medical Media, Ltd. pp. 283–285. ISBN 1-84110-100-1.
- ↑ Frank A. Redegeld, Maurice W. van der Heijden, Mirjam Kool, Bianca M. Heijdra, Johan Garssen, Aletta D. Kraneveld, Henk Van Loveren, Paul Roholl, Takashi Saito, J. Sjef Verbeek, Jill Claassens, Andries S. Koster & Frans P. Nijkamp. Immunoglobulin-free light chains elicit immediate hypersensitivity-like responses. Nature Medicine 8, 694–701 (2002). DOI 10.1038/nm722 [1]
- ↑ Anneke Rijnierse1, Alfons B.A. Kroese, Frank A. Redegeld, Bart R.J. Blokhuis, Maurice W. van der Heijden, Andries S. Koster, Jean-Pierre Timmermans, Frans P. Nijkamp, Aletta D. Kraneveld. Immunoglobulin-free light chains mediate antigen-specific responses of murine dorsal root ganglion neurons. Journal of neuroimmunology. March 31, 2009. Volume 208, números 1-2, páxinas 80–86. DOI http://dx.doi.org/10.1016/j.jneuroim.2009.01.008 [2]
- ↑ American Journal of Respiratory and Critical Care Medicine (Braber e Thio (2012))
Véxase tamén
editarOutros artigos
editarLigazóns externas
editar- Immunoglobulin Light Chains Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Recurso educativo sobre as cadeas lixeiras das inmunoglobulinas