Adhesina autotransportadora trimérica
En bioloxía molecular, as adhesinas autotransportadoras triméricas ou TAAs (polas súas siglas en inglés de trimeric autotransporter adhesin), son proteínas que se encontran na membrana externa das bacterias gramnegativas. As bacterias usan as TAAs para infectar as células dos seus hóspedes por medio dun proceso chamado adhesión celular.[1] As TAAs reciben tamén o nome de adhesinas superenroladas oligoméricas (OCAs, do inglés oligomeric coiled-coil adhesins). Esencialmente, son factores de virulencia, é dicir, factores que fan que as bacterias sexan máis daniñas e infectivas para o organismo hóspede.[2]

As TAAs son só un dos moitos métodos que teñen as bacterias para conseguir infectar aos seus hóspedes, e orixinar infeccións que dan lugar a doenzas como a pneumonía, sepse e meninxite. A maioría das bacterias infectan os seus hóspedes por un método que utiliza algunha vía de secreción. As TAAs forman parte destas vías de secreción, concretamente do sistema de secreción de tipo Vc.[3]
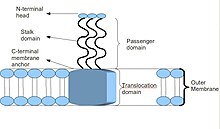
As TAAs teñen unha estrutura peculiar. Dita estrutura é esencial para a súa función. Todas parecen ter unha estrutura de tipo cabeza-talo-áncora. Cada TAA está feita de tres proteínas idénticas, e de aí vén que se denominen triméricas. Unha vez que a áncora de membrana está inserida na membrana externa bacteriana, o chamado dominio pasaxeiro pasa a través dela ata a contorna extracelular do hóspede de forma autónoma, de onde vén que se denominen autotransportadoras. O dominio da cabeza, unha vez ensamblado, adhirese seguidamente a un elemento do hóspede da matriz extracelular, por exemplo, o coláxeno, a fibronectina etc.[2]
Estrutura molecular editar
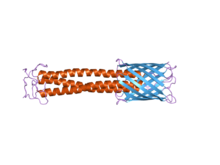
A maioría das TAAs teñen unha estrutura proteica similar. A súa estrutura ollada usando o microscopio electrónico describiuse como con forma dunha piruleta que consta dun dominio cabeza N-terminal, un dominio talo e un dominio áncora de membrana C-terminal.[2] A miúdo, na literatura distínguense só dúas partes e denomínanse estes dominios como dominio pasaxeiro (que contén o N-terminal, a cabeza, o pescozo e o talo superenrolado), e dominio de translocación (que comprende a áncora de membrana C-terminal). Aínda que todas as TAAs teñen en común a áncora de membrana, non todas conteñen un talo e unha cabeza. Ademais, todos o dominios áncora de membrana son do tipo rolo beta ou carrete beta (beta roll) paralelo levoxiro.[4]
Proteínas modelo editar
Todas as TAAs son factrores de virulencia esenciais de patóxenos que causan serias enfermidades en humanos. As máis estudadas e mellor coñecidas delas son as da lista seguinte:[1]
- YadA de Yersinia enterocolitica
- NadA de Neisseria meningitidis
- UspA1 e A2 de Moraxella catarrhalis
- Hia e Hsf de Haemophilus influenzae
- BadA de Bartonella henselae
| Dominio | Proteínas | |||||
|---|---|---|---|---|---|---|
| YadA | NadA | UspA1 | HadA | Hia | BadA | |
| Cabeza N-terminal | Hélice beta levoxira monocatenaria[5] | Cabeza globular[6] | Cabeza en propulsor beta[7] | Non presente | Prismas beta | Similar á cabeza YadA, contén unha hélice beta levoxira |
| Pescozo | Presente | Non presente | Presente | Presente | Presente | Presente |
| Pescozo | Hélice superenrolada dextróxira | Hélices alfa supereroladas seguidas dunha rexión de enlace | Hélice superenrolada estendida | Hélice superenrolada de tres hélices alfa | Hélice superenrolada de tres hélices alfa | Hélice superenrolada estendida |
| Áncora de membrana C-terminal | Estrutura en barril beta | Estrutura en barril beta | Estrutura en barril beta | Estrutura en barril beta | Estrutura en barril beta | Estrutura en barril beta |
Proceso de infección editar
O proceso de infección bacteriana é complicado. As bacterias invasivas deben superar moitas barreiras para infectar ao seu hóspede, entre as cales están barreiras ambientais, físicas e inmunitarias. A bacteria debe entrar no corpo do hóspede e, no caso de, por exemplo, Yersinia sp., invadir a mucosa intestinal do hóspede. Entón as adhesinas autotransportadoras triméricas deben adherirse á capa de células epiteliais da superficie interna intestinal, usando a súa cabeza para unirse a proteínas que se encontran na matriz extracelular, como o coláxeno, laminina e fibronectina.[8] É importante que estas adhesinas da membrana externa fagan contacto físico cos receptores que se atopan na matriz extracelular que rodea a célula hóspede. Isto significa que as adhesinas deben se longas dabondo como para estenderse alén da capa de lipopolisacárido na membrana externa da bacteria e interaccionar coa capa de glicano da célula hóspede.[9] unha vez que fixeron isto, poden unirse á matriz extracelular da célula hóspede. As TAAs son un tipo de MSCRAMMs (microbial surface components recognizing adhesive matrix molecules, ou compoñentes da superficie celular que recoñecen moléculas da matriz adhesiva). Noutras palabras, son un complexo que axuda á adhesión á matriz extracelular.[10]
Sistema de secreción de tipo V (T5SS) editar
A secreción nas bacterias gramnegativas é un método de transferir substancias a través da membrana bacteriana externa. As bacterias gramnegativas teñen unha estrutura da parede moi distinta á das grampositivas. As gramnegativas teñen tres capas: a capa máis interna é a membrana interna, a capa media é o espazo periplásmico (un espazo que contén unha fina capa de peptidoglicano) e a terceira capa é a membrana externa, que contén lipopolisacáridos.[11]
Nas bacterias gramnegativas, a vía secretora é moi diferente da dos eucariotas ou das bacterias grampositivas, principalmente polas diferenzas na parede celular.[12] As TAAs usan unha vía de secreción especial, chamada sistema de secreción de tipo V (T5SS). As bacterias gramnegativas deben segregar adhesinas, xa que teñen unha membrana externa que lles fai difícil adherirse ás células hóspede infectadas. A membrana externa é útil, xa que permite que as bacterias colonicen novos lugares, e engade outra capa protectora. Porén, esta membrana é unha barreira para a secreción de proteínas, e, en principio, cómpre gastar enerxía para que se transporten as proteínas a través dela. Pero a vía T5SS supera este problema.[12]
O T5SS utiliza un sistema dependente da maquinaria Sec para funcionar. O encima translocase Sec está presente na membrana interna. Estes sistemas dependentes de Sec non necesitan utilizar enerxía, a diferenza dos sistemas independentes da maquinaria Sec, que utilizan outras formas de enerxía como a hidrólise do ATP ou un gradiente de protóns. Como pode transportar moléculas través da membrana externa sen a necesidade de gastar ou xerar unha nova forma de enerxía, recibe o nome de autotransportador, xa que transporta as proteínas autonomamente.[13]
O sistema dependente de Sec está dividido en tres vías. As TAAs constitúen unha desas vías e tamén se chama vía secretora de tipo Vc. O mecanismo divídese en dous. Primeiro, a proteína debe moverse atravesando a membrana interna (translocándose), de maneira dependente de Sec a través do periplasma.[14] O péptido sinal situado no extremo N-terminal actúa como un amarre temporal que a mantén no seu lugar. Despois, debe desprazarse á membrana externa. A trimerización axuda á translocación, e non haberá translocación sen a súa áncora de membrana de barril beta.[3] O sistema de secreción de tipo V descríbese como non fimbrial, o que significa que a bacteria non utiliza os longos apéndices físicos da superficie celular chamados pili para unirse a outra célula.[15]
Evasión do sistema inmunitario do hóspede editar
As TAAs poden axudar a impedir que a bacteria sexa destruída polo sistema inmunitario do hóspede. En particular no caso de certas Yersinia spp., a TAA YadA exerce un papel na autoaglutinación, resistencia sérica, inactivación do complemento e resistencia á fagocitose. Todos estes métodos impiden que a bacteria sexa eliminada polo hóspede e aseguran a súa supervivencia.[8]
Notas editar
- ↑ 1,0 1,1 1,2 Szczesny P, Linke D, Ursinus A, Bär K, Schwarz H, Riess TM; et al. (2008). Ghosh, Partho, ed. "Structure of the head of the Bartonella adhesin BadA". PLoS Pathog 4 (8): e1000119. PMC 2483945. PMID 18688279. doi:10.1371/journal.ppat.1000119.
- ↑ 2,0 2,1 2,2 Linke D, Riess T, Autenrieth IB, Lupas A, Kempf VA (2006). "Trimeric autotransporter adhesins: variable structure, common function". Trends Microbiol 14 (6): 264–70. PMID 16678419. doi:10.1016/j.tim.2006.04.005.
- ↑ 3,0 3,1 Mikula KM, Leo JC, Łyskowski A, Kedracka-Krok S, Pirog A, Goldman A (2012). "The translocation domain in trimeric autotransporter adhesins is necessary and sufficient for trimerization and autotransportation". J Bacteriol 194 (4): 827–38. PMC 3272944. PMID 22155776. doi:10.1128/JB.05322-11.
- ↑ Szczesny P, Lupas A (2008). "Domain annotation of trimeric autotransporter adhesins--daTAA". Bioinformatics 24 (10): 1251–6. PMC 2373917. PMID 18397894. doi:10.1093/bioinformatics/btn118.
- ↑ Koretke KK, Szczesny P, Gruber M, Lupas AN (2006). "Model structure of the prototypical non-fimbrial adhesin YadA of Yersinia enterocolitica". J Struct Biol 155 (2): 154–61. doi:10.1016/j.jsb.2006.03.012. PMID 16675268.
- ↑ Tavano R, Capecchi B, Montanari P, Franzoso S, Marin O, Sztukowska M; et al. (2011). "Mapping of the Neisseria meningitidis NadA cell-binding site: relevance of predicted {alpha}-helices in the NH2-terminal and dimeric coiled-coil regions.". J Bacteriol 193 (1): 107–15. PMC 3019930. PMID 20971901. doi:10.1128/JB.00430-10.
- ↑ Agnew C, Borodina E, Zaccai NR, Conners R, Burton NM, Vicary JA; et al. (2011). "Correlation of in situ mechanosensitive responses of the Moraxella catarrhalis adhesin UspA1 with fibronectin and receptor CEACAM1 binding". Proc Natl Acad Sci U S A 108 (37): 15174–8. PMC 3174611. PMID 21876142. doi:10.1073/pnas.1106341108.
- ↑ 8,0 8,1 Nummelin H, Merckel MC, Leo JC, Lankinen H, Skurnik M, Goldman A (2004). "The Yersinia adhesin YadA collagen-binding domain structure is a novel left-handed parallel beta-roll". EMBO J 23 (4): 701–11. doi:10.1038/sj.emboj.7600100. PMC 381008. PMID 14765110.
- ↑ Meng G, St Geme JW, Waksman G (2008). "Repetitive architecture of the Haemophilus influenzae Hia trimeric autotransporter". J Mol Biol 384 (4): 824–36. doi:10.1016/j.jmb.2008.09.085. PMC 2597055. PMID 18948113.
- ↑ Harris LG, Richards RG (2006). "Staphylococci and implant surfaces: a review". Injury. 37 Suppl 2 (2): S3–14. PMID 16651069. doi:10.1016/j.injury.2006.04.003.
- ↑ Białas N, Kasperkiewicz K, Radziejewska-Lebrecht J, Skurnik M (2012). "Bacterial cell surface structures in Yersinia enterocolitica". Arch Immunol Ther Exp (Warsz) 60 (3): 199–209. doi:10.1007/s00005-012-0168-z. PMID 22484801.
- ↑ 12,0 12,1 Gerlach RG, Hensel M (2007). "Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens". Int J Med Microbiol 297 (6): 401–15. PMID 17482513. doi:10.1016/j.ijmm.2007.03.017.
- ↑ Leo JC, Grin I, Linke D (2012). "Type V secretion: mechanism(s) of autotransport through the bacterial outer membrane". Philos Trans R Soc Lond B Biol Sci 367 (1592): 1088–101. PMC 3297439. PMID 22411980. doi:10.1098/rstb.2011.0208.
- ↑ Kostakioti M, Newman CL, Thanassi DG, Stathopoulos C (2005). "Mechanisms of protein export across the bacterial outer membrane". J Bacteriol 187 (13): 4306–14. PMC 1151778. PMID 15968039. doi:10.1128/JB.187.13.4306-4314.2005.
- ↑ Leyton DL, Rossiter AE, Henderson IR (2012). "From self sufficiency to dependence: mechanisms and factors important for autotransporter biogenesis". Nat Rev Microbiol 10 (3): 213–25. doi:10.1038/nrmicro2733. PMID 22337167.