Sintaxina
As sintaxinas son unha familia de proteínas integrais de membrana de tipo Q-SNARE que participan na exocitose.[2]
| Sintaxina | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
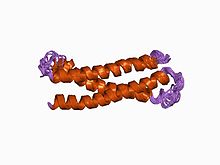 Estrutrura dun dominio N-teminal conservado evolutivamente da sintaxina 1A.[1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Syntaxin | ||||||||||
| Pfam | PF00804 | ||||||||||
| InterPro | IPR006011 | ||||||||||
| SMART | SM00503 | ||||||||||
| SCOPe | 1br0 / SUPFAM | ||||||||||
| OPM superfamily | 218 | ||||||||||
| OPM protein | 3hd7 | ||||||||||
| |||||||||||
Dominios editar
As sintaxinas posúen un único dominio transmembrana C-terminal, un dominio SNARE (chamado H3), e un dominio regulador N-terminal (Habc). A sintaxina 17 pode ter dous dominios transmembrana.
- O dominio SNARE (H3) únese tanto á sinaptobrevina coma á SNAP-25 formando o complexo SNARE central (core). A formación deste complexo SNARE central moi estable crese que xera a enerxía libre necesaria para iniciar a fusión entre a membrana da vesícula e a membrana plasmática durante a exocitose.
- O dominio N-terminal Habc está formado por 3 hélices α e cando se colapsa sobre a súa propia hélice H3 orixina unha conformación da sintaxina "pechada" inactiva. Esta conformación pechada da sintaxina crese que se estabiliza ao unirse á proteína Munc-18 (nSec1), aínda que datos máis recentes suxiren que nSec1 pode unirse tamén a outras conformacións da sintaxina. A conformación "aberta" da sintaxina é a conformación que é competente para formar parte do complexo SNARE central.
Función editar
In vitro a sintaxina por si soa é dabondo para impulsar a fusión espontánea independente do calcio de vesículas sinápticas que conteñen v-SNAREs.[4]
Datos amperométricos máis recentes e algo controvertidos indican que o dominio transmembrana da sintaxina 1A pode formar parte do poro de fusión que se forma na exocitose.[5]
Unión editar
A sintaxina únese á sinaptotagmina de modo dependente do calcio e pode interaccionar con canles de calcio e potasio regulados por voltaxe por medio do dominio C-terminal H3. A interacción directa sintaxina-canle é un mecanismo molecular axeitado para a proximidade entre a maquinaria de fusión e as canles de entrada de Ca2+ durante a despolarización do botón axonal presináptico.
A familia da proteína Sec1/Munc18 únese á sintaxina e regula a maquinaria das sintaxinas. Munc18-1 únese á sintaxina 1A por medio de dous sitios distintos denominados unión N-terminal e conformación "pechada", que incorpora tanto o dominio Habc central coma o dominio SNARE central. A unión de Munc18-1 ao N-terminal da sintaxina-1 crese que facilita a interacción da sintaxina-1 con outro SNARE, mentres que a unión á conformación "pechada" da sintaxina-1 crese que é inhibidora.
Datos publicados recentemente indican que a sintaxina-1 orixinada por splicing alternativo (STX1B), que carece de dominio transmembrana, localízase no núcleo.[6]
Xenes editar
Xenes humanos que codifican proteínas sintaxinas:
Notas editar
- ↑ Fernandez I, Ubach J, Dulubova I, Zhang X, Südhof TC, Rizo J (September 1998). "Three-dimensional structure of an evolutionarily conserved N-terminal domain of syntaxin 1A". Cell 94 (6): 841–9. PMID 9753330. doi:10.1016/S0092-8674(00)81742-0.
- ↑ Bennett MK, García-Arrarás JE, Elferink LA, Peterson K, Fleming AM, Hazuka CD, Scheller RH (September 1993). "The syntaxin family of vesicular transport receptors". Cell 74 (5): 863–73. PMID 7690687. doi:10.1016/0092-8674(93)90466-4.
- ↑ Georgiev, Danko D .; James F . Glazebrook (2007). "Subneuronal processing of information by solitary waves and stochastic processes". En Lyshevski, Sergey Edward. Nano and Molecular Electronics Handbook. Nano and Microengineering Series. CRC Press. pp. 17–1–17–41. ISBN 978-0-8493-8528-5. Arquivado dende o orixinal o 16 de xaneiro de 2016. Consultado o 13 de agosto de 2015.
- ↑ Woodbury DJ, Rognlien K (2000). "The t-SNARE syntaxin is sufficient for spontaneous fusion of synaptic vesicles to planar membranes". Cell Biol. Int. 24 (11): 809–18. PMID 11067766. doi:10.1006/cbir.2000.0631.
- ↑ Han X, Wang CT, Bai J, Chapman ER, Jackson MB (April 2004). "Transmembrane segments of syntaxin line the fusion pore of Ca2+-triggered exocytosis". Science 304 (5668): 289–92. PMID 15016962. doi:10.1126/science.1095801.
- ↑ Pereira S, Massacrier A, Roll P, Vérine A, Etienne-Grimaldi MC, Poitelon Y, Robaglia-Schlupp A, Jamali S, Roeckel-Trevisiol N, Royer B, Pontarotti P, Lévêque C, Seagar M, Lévy N, Cau P, Szepetowski P (November 2008). "Nuclear localization of a novel human syntaxin 1B isoform". Gene 423 (2): 160–71. PMID 18691641. doi:10.1016/j.gene.2008.07.010.
Véxase tamén editar
Outros artigos editar
Ligazóns externas editar
- Syntaxin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.