Rascón de auga
O rascón de auga[2][3] ou, simplemente, rascón[4] (Rallus aquaticus) é unha ave da familia dos rálidos, que se reproduce en zonas húmidas ben cubertas de vexetación de Europa, Asia e norte de África. As poboacións do norte e leste son migratorias, pero esta especie é sedentaria durante todo o ano nas partes máis cálidas da súa área reprodutora. En Galicia é unha ave nativa sedentaria.[2] O adulto é unha ave de 23 a 28 cm de longo e, igual que outros membros da súa familia, ten un corpo aplanado lateralmente, o que lle facilita pasar entre a vexetación de xuncos do hábitat onde vive. A súa parte superior é principalmente marrón e a inferior gris azulada, con barras negras nos flancos, dedas longas, cola curta e peteiro longo e avermellado. Os exemplares inmaturos son xeralmente similares en aparencia aos adultos, mais a cor gris azulada da plumaxe é substituída por beixe. Os polos cubertos de penuxe son negros, como é característico nos rálidos. A antiga subespecie R. a. indicus, ten marcas distintivas e unha chamada que é moi diferente do chío parecido ao dun porco das razas occidentais e agora xeralmente se separa como unha especie diferente co nome Rallus indicus.
| Rascón de auga | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||
| Estado de conservación | |||||||||||||||
 Pouco preocupante[1] | |||||||||||||||
| Clasificación científica | |||||||||||||||
| |||||||||||||||
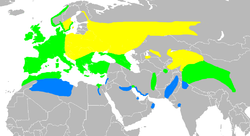 Visitante estival reprodutor (distribucións aproximadas)Residente todo o ano Visitante invernal Visitante estival reprodutor (distribucións aproximadas)Residente todo o ano Visitante invernal | |||||||||||||||
Reprodúcese en xunqueiras e outros sitios pantanosos con vexetación alta e densa, construíndo o niño un pouco por riba do nivel da auga coas plantas das que dispoña na contorna. Os seus ovos abrancazados e con manchas son incubados principalmente pola femia, e as crías fan eclosión en de 19 a 22 días e son precoces. A femia defende os ovos e pitos contra os intrusos ou trasládaos a outro lugar se son descubertos. Pode reproducirse ao chegar a un ano de idade e normalmente fai dúas postas en cada tempada. Son omnívoros que se alimentan principalmente de invertebrados durante o verán e de bagas ou talos de plantas durante o inverno. Son animais territoriais incluso rematada a reprodución e defenden agresivamente as súas áreas de alimentación en inverno.
Son vulnerables ás inundacións ou ás temperaturas de conxelación, á perda de hábitat e predación por mamíferos e grandes aves. Os visóns americanos introducidos exterminaron algunhas poboacións de illas, pero en conxunto a amplísima área de distribución da especie e a gran cantidade de exemplares que hai fan que sexa considerada unha especie non ameazada.
Taxonomía editar
Os rálidos son unha familia que comprende case 150 especies. Aínda que as orixes do grupo son moi antigos, o maior número de especies e as formas máis primitivas encóntranse no Vello Mundo, o que suxire que esta familia se orixinou alí. Porén, o xénero Rallus, o grupo dos especialista de longo peteiro en vivir nas xunqueiras ao que pertence o rascón de auga, orixinouse no Novo Mundo. Os seus membros do Vello Mundo, os rascóns de África continental Rallus caerulescens e os de Madagascar Rallus madagascariensis, forman unha superespecie, e pénsase que evolucionaron a partir dunha soa invasión de aves que atravesaron o Atlántico.[5] As probas xenéticas indican que o rascón de auga é o máis estreitamente relacionado deste xénero cos rascóns Gallirallus do Pacífico,[6] e é basal para ese grupo.[7] O rascón de auga foi descrito primeiramente por Linnaeus na súa obra Systema Naturae en 1758 co seu nome científico actual Rallus aquaticus,[8] significado que equivale en latín ao seu nome común.[9][10][11]
A antiga subespecie R. a. indicus ten vocalizacións moi diferentes das do rascón de auga e nos traballos recentes é considerada unha especie separada.[12] Foi restaurada como especie de seu co nome R. indicus por Pamela Rasmussen na súa obra Birds of South Asia (2005).[13][14] O tratamento que lle dá esta autora conseguiu aceptación e é tamén o seguido en Birds of Malaysia and Singapore (2010).[15] Un estudo de 2010 da filoxenia molecular deu un apoio adicional á posibilidade de dar un status de especie a R. indicus, que se pensa diverxeu das formas occidentais hai arredor de 534 000 anos.[16]
Fósiles editar
Os fósiles máis antigos coñecidos dun rascón de auga ancestral son uns ósos atopados nos Cárpatos datados no Plioceno (hai 1,8-5,3 millóns de anos). Ao final do Plistoceno, hai dous millóns de anos, as evidencias fósiles suxiren que o rascón de auga xa estaba presente na maioría da súa área de distribución actual.[16] Esta especie está ben representada no rexistro fósil, cuns 30 achados tan só en Bulgaria e moitos outros no sur de Europa[17][18] e a China.[19] Un antigo rascón da illa de Eivisa, Rallus eivissensis, era máis pequeno pero máis robusto que o rascón de auga e probablemente tiña peor capacidade de voo. No Cuaternario, a illa carecía de mamíferos terrestres, e esta distintiva forma de rascón seguramente descendía dun devanceiro do continente. Extinguiuse aproximadamente ao mesmo tempo que o ser humano chegou á illa,[20] entre os anos 16 700 e 5 300 a.C..[21] A raza nominal do rascón de auga é agora unha ave residente moi rara na illa de Eivisa.[22]
Descrición editar
O adulto da subespecie nominal é un rascón de mediano tamaño, de 23 a 28 cm de longo cunha envergadura alar de 38 a 45 cm[23]. Os machos pesan normalmente de 114 a 164 g e as femias son lixeiramente menos pesadas, de 92 a 107 g.[24] As partes superiores desde a fronte á cola son marróns oliváceas con liñas negras, especialmente nos ombreiros. A parte lateral da cabeza e as partes inferiores ata a parte superior da barriga son azul lousa escuras, agás unha área negra entre o peteiro e o ollo, e laterais amarronados ata o peito superior. Os flancos teñen barras negras e brancas e a parte subcaudal é branca con algunhas liñas máis escuras. O seu longo peteiro e o iris son vermellos e as patas son de cor marrón carne. Ambos os sexos son similares, e aínda que a femia como media é lixeiramente menor que o macho e con peteiro máis delgado,[25] determinar o sexo só polas medidas non é fiable.[26] Os xoves teñen un píleo anegrado e un queixo e gorxa brancos. As partes inferiores son beixes ou brancas con barras máis escuras, e as marcas dos flancos son marróns e beixes en lugar de negras e brancas. A parte subcaudal é beixe, e o ollo, peteiro e patas son de cores máis claras que as do adulto. Os polos cubertos de penuxe son completamente negros excepto o seu peteiro principalmente branco.[25] Despois da reprodución, sofre unha ampla muda e perde a capacidade de voar durante tres semanas.[1] Os adultos poden identificarse individualmente polas marcas subcaudais, que son únicas para cada exemplar. Os machos adultos son os que teñen as liñas subcaudais máis nítidas.[27] Suxeriuse que as barras escuras subcaudais desta especie son un compromiso entre a función de sinalización que tería unha zona subcaudal completamente branca, como a que teñen as especies de augas abertas e as gregarias como a galiña de río, e a necesidade de evitar ser demasiado visible.[28]
O rascón de auga pode distinguirse doadamente da maioría dos outros rascóns das xunqueiras pola súa zona subcaudal branca e peteiro encarnado; ademais, o peteiro é un pouco máis longo que o resto da cabeza do animal (de 55 a 58% do total) e lixeiramente curvado cara a abaixo.[29] A especie de Asia tropical que se parece algo Gallirallus striatus ten un peteiro máis robusto, un píleo castaño e partes inferiores con manchas brancas. Os xoves e os exemplares que acaban de mudar poden presentar unha zona subcaudal beixe como a da galiñola pinta, mais a plumaxe desa especie ten manchas brancas e un peteiro moito máis curto e principalmente amarelado. A área de distribución do rascón de auga non se solapa co de ningunha outra especie de Rallus, pero os individuos errantes poderían distinguirse dos seus parentes americanos pola falta de cor avermellada ou castaña coas ás pechadas. A especie máis grande de África Rallus caerulescens ten partes superiores marróns máis escuras sen liñas e patas e pés dun vermello máis vivo.[25]
Vocalizacións editar
É unha especie vocalizadora que fai a súa chamada durante todo o ano. Consiste nunha serie de gruñidos seguidos dun chío agudo parecido ao dos bácoros, que acaba con máis gruñidos. Utilízase como chamada territorial, de alarma e anuncio. Os dous membros da parella poden facer a chamada alternativamente, o macho con notas máis lentas e baixas que a femia. A canción de cortexo, que ambos sexos cantan, é unha especie de tyic-tyic-tyic que adoita rematar cun trilo da femia; o macho pode cantar sen parar durante horas. A chamada de voo é un asubío sostido, e outras vocalizacións son un renxido repetido alto que fai o macho cando mostra o sitio de nidación á femia e un rumbar que fan ambos cando están no niño cos polos. Son máis vocais cando establecen un territorio e ao inicio da estación reprodutora, cando as chamadas poden continuar pola noite. Os polos inicialmente pían feblemente, pero axiña desenvolven unha chamada de rogo tipo tyk-tyk-trik.[25]
Cando os investigadores colocan altofalantes que reproducen gravacións da chamada da folosa das canaveiras de noite para atraer a este paxariño para atrapalo, observan que os rascóns de auga e outras aves acuáticas tamén baixan a terra, a pesar de que o hábitat non sexa o axeitado para elas, o que indica que os rascóns e outros migrantes nocturnos recoñecen a canción desa folosa e asóciana co hábitat de pantano ou marisma no cal xeralmente vive.[30]
Subespecies editar
Recoñécense tres subespecies.[25]
- R. a. aquaticus (Linnaeus, 1758). Esta é a especie nominal que se reproduce en Europa, norte de África, Turquía, oeste de Asia ata o mar Caspio e o oeste de Casaquistán e nunha estreita banda caro ao leste ata Siberia central.[25]
- R. a. hibernans (Salomonsen, 1931). É a raza islandesa, que ten partes superiores dun marrón lixeiramente máis cálido que a forma nominal. As barras dos flancos son marróns escuras, non negras, e o peteiro é algo máis curto; o gris das partes inferiores pode ter un lixeiro ton marrón.[25]
- R. a. korejewi (Zarudny, 1905) (inclúe as formas dubidosas deserticolor, tsaidamensis e arjanicus). Esta subespecie reprodúcese no sur de Asia central desde o sur e leste de Irán cara ao leste ata o leste da China (ás veces en Beijing, Shanghai etc.), e no subcontinente indio en Caxemira e Ladakh. É lixeiramente máis grande que a raza nominal, con partes superiores marróns máis claras e partes inferiores cor lousa algo máis claras. Ten unha banda marrón débil que cruza o ollo.[25][31]
As diferenzas entre as tres razas parecen ser clinais e é posible que todas deban fusionarse en R. a. aquaticus.[16] A antiga subespecie R. a. indicus considérase agora a especie R. indicus.
Distribución e hábitat editar
Reprodúcese nas zonas temperadas de Eurasia desde Islandia e as illas británicas descontinuamente ata o norte de África, Arabia Saudita e oeste da China. A súa distribución en Asia está pouco estudada.[25] En Galicia a primeira cita é de López Seoane en 1866, atopándose na actualidade principalmente na franxa costeira.[32]
A poboación islandesa de R. a. hibernans extinguiuse arredor de 1965 como resultado da perda de hábitat pola drenaxe de zonas húmidas e a predación polo visón americano introducido.[16] Antes da súa extinción, polo menos algunhas desas aves estaban presentes todo o ano na illa, dependendo de fontes termais volcánicas para sobrevivir durante os meses máis fríos, pero esta raza encontrábase tamén en inverno nas illas Feroe e Irlanda, e como ave de paso nas illas Hébridas Exteriores, o que suxire que a forma islandesa era unha migrante parcial.[33]
A subespecie nominal, R. a. aquaticus, é residente na parte sur e oeste, de clima máis suave, da súa área, pero migra ao sur desde áreas que están sometidas a invernos duros. Inverna dentro da súa área de reprodución e tamén máis ao sur no norte de África, Próximo Oriente e a área do mar Caspio. O pico de migración é entre setembro e outubro, e a maioría destas aves volven aos seus terreos de reprodución desde marzo á metade de abril.[33] Un espécime da poboación nominal etiquetada como de "Baluchistán" e recollida por Richard Meinertzhagen é considerada de dubidosa procedencia.[34] R. a. korejewi é outro migrante parcial, con parte da poboación que inverna en Iraq e leste de Arabia Saudita e cara ao leste a través de Paquistán e norte da India ata ao oeste da China.[25]
O hábitat reprodutor do rascón de auga son as zonas húmidas permanentes de augas doces ou salobres quietas ou lentas e con densa vexetación alta, entre a cal pode haber plantas como Phragmites, Typha, Iris, Sparganium ou Carex.[25] En áreas costeiras, é común o Juncus maritimus en sitios reprodutores de marismas de augas salgadas, con predominio de Carex e Sparganium en ambientes algo menos salinos. Un estudo nos Países Baixos e España mostrou que os xuncos proporcionan unha ocultación mellor que outras plantas marítimas. Como noutros lugares, os niños son construídos coas plantas dispoñibles máis á man.[35] O Cladium mariscus, onde o hai, proporciona un bo hábitat reprodutor, a súa densa estrutura de 1,5 m de altura proporciona unha boa cobertura para os rascóns nidificadores.[36] O hábitat preferido son as xunqueiras con Phragmites con plantas que emerxen da auga,[37] cunha profundidade de 5 a 30 cm, áreas lamacentas para alimentarse e unha rica diversidade de especies de invertebrados. As localizacións con salgueiros ou arbustos nas proximidades son as preferidas sobre as áreas grandes de hábitat uniforme. Ademais dos pantanos ou marismas naturais de auga fresca ou mariña, este rascón pode utilizar escavacións para extraer grava ou arxila e turbeiras traballadas sempre e cando sexan un hábitat axeitado con boa cobertura. Pode encontrarse en campos de arroz ou en illas flotantes,[25] e en Caxemira pode vivir en campos de cana de azucre asolagados.[31] Un estudo finlandés mostrou que o principal factor que inflúe na distribución dos rascóns de auga é a cobertura de vexetación, coas maiores densidades nas áreas con máis vexetación; a presenza doutras marismas nas proximidades é tamén significativa. Porén, factores como a temperatura, chuvias, lonxitude da liña de costa e a extensión de zona de turba, que son importantes para algunhas outras aves de marisma, non son estatisticamente relevantes. As áreas coas maiores densidades de rescóns tamén eran as que tiñan maiores cantidades das tres especies consideradas en risco en Finlandia, a folosa grande, o abetouro común e o tartaraña das xunqueiras.[38] O límite norte da área de reprodución parece estar determinado pola transición das zonas húmidas ricas en nutrientes a máis pobres e de augas máis ácidas. Isto fai que os xuncos comúns se substitúan por un tipo de vexetación máis aberta dominada por Comarum palustre, que non é axeitada para os rascóns.[39]
Ocasionalmente, utilizan localizacións menos frecuentes. Unha parella en Escocia nidificou en campo aberto á beira dunha estrada, e cando se instalaron caixas de nidificación para Panurus biarmicus ("casetas" de xuncos con piso de madeira), os rascóns nidificaron tanto nas caixas coma baixo o piso de madeira, nestre último caso ás veces cos Panurus vivindo arriba.[40] Aínda que principalmente é unha especie de terras baixas, os rascóns de auga reprodúcense a 1240 m de altura nos Alpes e a 2000 m en Armenia.[25] Un estudo italiano suxeriu que as aves das xunqueiras necesitan unha área mínima de zona húmida para reproducirse, a cal para o rascón de auga é de 1 ha,[41] aínda que as maiores densidades se dan en marismas de 10 ha ou máis.[38]
Durante a migración ou en inverno, poden usar unha ampla variedade de hábitats, incluíndo as matogueiras asolagadas ou fenteiras. As temperaturas de conxelación poden forzar as aves a ir a localizacións máis abertas como as canles, vertedoiros de lixo e xardíns,[25] ou mesmo sobre xeo exposto.[42] Un estudo galés suxeriu que os territorios invernais individuais se solapan, e cada ave usa unha porción significativa da xunqueira. Despois do abandono do sitio cando as temperaturas son baixo cero, as aves regresan á súa área anterior. Rexistrouse unha densidade de 14 aves por hectárea.[43] As aves que invernan en Islandia dependen de regatos cálidos xeotermais e poden acceder aos regatos a través de túneles baixo a neve. Cando non se alimentan, poden refuxiarse en buratos e gretas entre a lava solidificada.[25] Esta especie ás veces deambula ata saír bastante fóra da súa área normal e atopáronse aves errantes nos Azores, Madeira, Mauritania, o Ártico,[33] Groenlandia, Malaisia e Vietnam.[1]
Comportamento editar
Este rascón é unha ave que rolda o seu territorio, a súa plumaxe veteada fai que sexa difícil de ver no seu hábitat pantanoso. O seu corpo está comprimido lateralmente o que lle axuda a esguirse entre a vexetación máis espesa, e ten o comportamento de deterse e quedar como "conxelado" se é sorprendido en zonas abertas.[44] Camiña con alancadas altas, aínda que adopta unha postura agachada cando corre buscando esconderse. Cando lle cómpre pode botarse a nadar, co movemento errático típico dos rascóns,[33] e voa durante curtas distancias a baixa altura sobre os xuncos coas súas longas patas colgando. Aínda que o seu voo parece débil, poden facer voos longos sostidos durante as súas migracións nocturnas,[31] e por veces morren debido a choques con arames ou faros.[44] Hai casos de exemplares anelados en Gran Bretaña que foron despois recollidos en Polonia, Checoslovaquia e Suecia.[45]
Defende os seus territorios de reprodución e invernada. As aves cargan unhas contra outras co pescozo estirado cando están en época reprodutora e ás veces ambos os membros da parella atacan xuntos. Os machos grandes con marcas máis fortes son os dominantes en inverno, cando a agresión directa é substituída por cantos feitos ergueitos sobre a punta das dedas, sacudidas da cabeza e estocadas co peteiro.[25]
Reprodución editar
É unha especie monógama e moi territorial cando se reproduce. A parella fórmase despois de chegaren ás áreas de nidificación ou posiblemente incluso antes da migración primaveral. Nas zonas húmidas grandes con boas condicións para estas aves as parellas poden nidificar separadas por unha distancia de entre 20 e 50 m. Os territorios varían en tamaño, pero o típico é de 300 m2. A parella fai chamadas de cortexo e de contacto durante a estación reprodutora. O macho selecciona o sitio para o niño e móstrallo á femia mentres adopta unha postura coas plumas do dorso ergueitas, ás arqueadas sobre o dorso, cola estirada e peteiro apuntando verticalemnte cara a abaixo. Esta exhibición vai acompañada dunha chamada alta. Antes de aparearse el ergue as ás e cola e inclínase co seu peteiro tocando o seu propio peito. O macho alimenta a femia durante o cortexo e, cando están chocando os ovos, ela pode abandonar o niño para facerlle unha exhibición ao macho, camiñando arredor del, chamando suavemente, fretando o seu peteiro co peito del e facendo pequenas carreiras dun lado para outro.[25]
O niño está feito de calquera materia vexetal que estea dispoñible e é construído principalmente polo macho, normalmente nun só día. O niño érguese a uns 15 cm ou máis por riba do nivel da auga da marisma, e é ás veces construído sobre matas de raíces, tocos de árbores ou soportes similares. Poden construílo máis alto se as augas da marisma empezan a subir. O niño é de 13 a 16 cm de diámetro e uns 7 cm de alto. Está ben escondido e accesible por estreitos camiños.[25][44][46]
A posta típica é de 6 a 11 ovos na maior parte da súa área de distribución,[25][33] pero parece ser menor (de 5 a 8) en Caxemira a altitudes de 1 500 m.[31] As datas de posta varían coa localidade, e son desde finais de marzo en Europa occidental e norte de África, ata finais de maio en Caxemira e xuño en Islandia.[25] O tamaño de posta pode ser menor a principios ou finais da estación reprodutora.[47] A estación reprodutora pode ampliarse por mor de resituar a posta ou facer unha segunda posta. Os ovos son romos e ovais, lisos e lixeiramente brillantes; a cor varía desde abrancazado a beixe rosado, con manchas marróns avermelladas no extremo máis ancho,[33] que ás veces se fusionan nunha soa mancha grande.[46] A variación no tamaño dos ovos entre as subespecies é moito menor que as diferenzas entre ovos individuais; a media de tamaño dos ovos da subespecie nominal, que é 36 × 26 mm, é o típico para toda a especie. Os ovos pesan uns 13 g,[25] dos cales o 7% corresponde á casca.[9]
Ambos os pais incuban os ovos, aínda que a femia fai a maior parte.[31] Os ovos son incubados durante 19 a 22 días ata a eclosión,[9] con polo menos un 87% de éxito.[45] O alimento é traído ao niño polo outro proxenitor e pasado ao que está sentado no niño, o cal alimenta os polos. Os poliños cubertos de penuxe son precoces, xa que abandonan o niño aos dous días da eclosión, pero continúa sendo alimentado polos seus pais, aínda que tamén encontran parte da comida por si mesmos desde os cinco anos de vida.[25] Son independentes dos seus pais aos 20 a 30 días[9] e poden voar ás 7 a 9 semanas.[25] Se a femia cre que o niño foi descuberto, pode transportar os ovos ou os polos un por un a outro lugar; os ovos son transportados no peteiro,[44] pero os polos pequenos pode metelos baixo as ás.[40] Os exemplares que están incubando poden permanecer sobre os ovos mesmo cando algún intruso se achega bastante preto, atacar ao intruso, ou finxir estar ferido como distración.[25] O rascón de auga pode reproducirse ao cumprir un ano e normalmente crían dúas roladas.
A supervivencia media despois de emplumar estimouse entre 17 e 20 meses, cunha taxa de supervivencia anual lixeiramente menor do 50% ao ano durante os primeiros tres anos, e algo maior despois.[45] A idade máxima rexistrada é de 8 anos e 10 meses.[9]
Alimentación editar
Os rascóns de auga son omnívoros, aínda que se alimentan principalmente de animais, como samesugas, vermes, gasterópodos, pequenos crustáceos, arañas e unha ampla variedade de insectos terrestres e acuáticos e as súas larvas. Poden matar ou comer como prea pequenos vertebrados, como anfibios, peixes, aves e mamíferos. Os vertebrados son empalados cun golpe do peteiro que rompe a medula espiñal da presa. A comida vexetal consómena máis en outono e inverno, e consta de xemas, flores, brotes e sementes de plantas acuáticas, bagas e outras froitas.[25] No sur de Asia, poden comer ás veces en campos de arroz (grans de arroz que encontran despois da colleita).[31] Os xoves son alimentados principalmente de insectos e arañas. O alimento obtido en terra ou no barro é normalmente lavado na auga antes de tragalo.[25] Despois de chover, poden sondar o chan mol procurando miñocas.[27] Esta especie aliméntase ocasionalmente en zonas abertas incluso cando non está forzado a facelo polas baixas temperaturas; Edmund Meade-Waldo describiu sete rascóns que se alimentaban nun prado aberto.[49] Malia a súa natureza de animal roldador, o rascón de auga parece prosperar en catividade cando se lle dá de comer alimentos animais como carne crúa ou miñocas;[50] un individuo foi ensinado a saltar para coller vermes pendurados en alto dunha liña de cana de pescar.[40]
Os rascóns de auga seguen rutas definidas cando se alimenta, tornando frecuentemente ás boas áreas de alimentación. Estes rascóns son versátiles e oportunistas á hora de alimentarse. Choutan para apañar insectos que están sobre plantas, trepan para atopar bagas, ou arrincan mazás das árbores para poder comelas no chan.[25] Matan aves atravesándoas co peteiro ou afogándoas, especialmente se a capacidade da ave de fuxir está restrinxida. Informouse que mataron un verderolo común e un paspallás chinés Excalfactoria chinensis nun aviario, e pequenos paxaros atrapados en redes de néboa dos aneladores de aves. Un exemplar matou un liñaceiro bicoamarelo capturado nunha trampa de Heligoland (ou de túnel).[40] Son tamén predaores de niños, especialmente de pequenas aves que aniñan en xunqueiras, como a folosa grande.[51] Os rascóns de auga poden defender un territorio de alimentación invernal, aínda que este é de menor tamaño cando se reproducen, con individuos separados a menos duns 10 m;[25] e os lugares preferidos poden albergar centos de aves.[48] O comportamento agresivo fóra da estación reprodutora pode ampliar os ataques contra outros rálidos das marismas, como a galiñola pinta e a galiñola anana.[52]
Predadores e parasitos editar
Entre os predadores do rascón de auga están diversos mamíferos e grandes aves. O visón americano foi parcialmente responsable da extinción da poboación islandesa,[16] e os gatos e cans tamén matan esta especie.[45] Polo menos localmente, as londras comen rascóns e outras aves acuáticas.[54] O abetouro común, que é outra ave das xunqueiras, come rascóns,[55] e tamén o fai a garza real.[56] Os rascóns de auga son especialmente vulnerables á depredacion das grazas cando son forzados a saír da protección dos xuncos por mareas moi altas.[40] Os tartarañas que cazan nas zonas húmidas son predadores previsibles,[57] pero o máis habitual é que sexan presas da avelaiona,[58] a curuxa das xunqueiras,[59] o bufo real,[60] a aguia manchada,[61] o lagarteiro,[62] e os falcóns peregrinos que cazan de noite.[63]
Entre os seus parasitos están os piollos Nirmus cuspidiculus e Pediculus ralli,[64][65] a carracha Ixodes frontalis,[66] e a mosca hipobóscida Ornithomyia avicularia.[67] O rascón de auga pode ser infectado tamén polo virus da gripe aviaria[68][69] e a bacteria Borrelia burgdorferi, transmitida polas carrachas Ixodes, que é tamén un patóxeno humano que causa a enfermidade de Lyme.[70] Descubríronse tres especies de piollos, Fulicoffula rallina, Pseudomenopon scopulacorne e cuspidatus en rascóns mortos en 2005 nas illas Faroe, que son especies que non se atoparan antes no arquipélago.[71] O verme plano parasito Ophthalmophagus nasciola atopouse tamén nas fosas nasais dun rascón,[72] e detectáronse polo menos tres especies de piollos das plumas na súa plumaxe.[73] O piollo Philopterus ralli e o nematodo Strongyloides avium atopáronse no estreitamente emparentado R. indicus.[74][75]
Status editar
A cantidade de rascóns de auga está declinando, pero, malia todo, ten unha gran poboación de 100 000 a 1 000 000 de adultos e unha enorme área de reprodución calculada en 15 600 000 km2; por todo o cal está clasificado como especie pouco preocupante na Lista vermella da IUCN.[1] Na maioría dos países europeos, a poboación é estable ou está diminuíndo lixeiramente debido á perda de hábitat. En Marrocos está aumentando o seu número e expandindo a área reprodutora e reprodúcese incluso bastante ao sur en Oued Massa.[33] Sábese pouco sobre a súa área en Asia, pero o korejewi é un reprodutor común en Paquistán e Caxemira.[34]
Os predadores introducidos son unha ameaza para as poboacións vulnerables de illas. Ademais da extinción da raza islandesa, o visón foi responsable de acusados declives nas poboacións de rascóns de auga e outras aves que se reproducen no chan nas illas Hébridas, onde as londras comedoras de peixe eran os únicos predadores nativos. Estes visóns proceden de exemplares escapados de granxas peleteiras.[76][77] Os programas de erradicación de visóns e furóns permitiron que os rascóns volvesen a esas illas,[78] e están previstos novos programas para o resto do territorio escocés.[79] Localmente, o seu hábitat pode ser afectado polo desecamento de marismas e pantanos, canalizacións de cursos de auga, crecemento urbano,[80] e pola contaminación.[81]
Os humanos levan comendo rascóns de auga desde hai miles de anos;[82] xa os comían os romanos,[83][84] e aparecen representados nas pinturas dos muros de Pompeia,[85] e o seu consumo continuou durante a Idade Media e nos tempos modernos.[86]
Notas editar
- ↑ 1,0 1,1 1,2 1,3 "Rallus aquaticus". Lista Vermella de especies ameazadas. Versión 2014.3 (en inglés). Unión Internacional para a Conservación da Natureza. 2014. Consultado o 24 de maio de 2015.
- ↑ 2,0 2,1 Penas Patiño, Xosé M.; Pedreira López, Carlos (setembro de 2004). Guía das aves de Galicia. Ilustrado por Calros Silvar (2ª ed.). A Coruña: Baía Edicións. ISBN 84-96128-69-5.
- ↑ Definición de Rascón de auga no Dicionario de Galego de Ir Indo e a Xunta de Galicia.
- ↑ Conde Teira, M. A. (1999). "Nomes galegos para as aves ibéricas: lista completa e comentada" (PDF). Chioglossa (A Coruña) 1: 121–138. Arquivado dende o orixinal (PDF) o 15 de marzo de 2016. Consultado o 28 de setembro de 2016.
- ↑ Taylor & van Perlo 2000, p. 29
- ↑ Christidis, Les; Boles, Walter (2008). Systematics and taxonomy of Australian birds. Collingwood, Victoria: CSIRO. p. 120. ISBN 978-0-643-06511-6.
- ↑ Trewick, S.A. (1997). "Flightlessness and phylogeny amongst endemic rails (Aves: Rallidae) of the New Zealand region". Philosophical Transactions of the Royal Society of London B 352 (1352): 429–446. PMC 1691940. PMID 9163823. doi:10.1098/rstb.1997.0031.
- ↑ Linnaeus, C. (1758). Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata. (en latín). Holmiae (Stockholm): Laurentii Salvii. p. 153.
- ↑ 9,0 9,1 9,2 9,3 9,4 "Water Rail Rallus aquaticus [Linnaeus, 1758]". BTO BirdFacts. British Trust for Ornithology. Consultado o 14 de abril de 2011.
- ↑ Willughby, Francis (1676). Ornithologiae libri tres (en latín). Londres: John Martyn. p. 234.
- ↑ Albin, Eleazar; Derham, William (1731). A Natural History of Birds : Illustrated with a Hundred and One Copper Plates, Curiously Engraven from the Life. Volume 1. Londres: Printed for the author and sold by William Innys. p. 73.
- ↑ Blanford, W T (1898). The Fauna of British India, Including Ceylon and Burma. Birds, volume 4. Londres: Taylor and Francis. pp. 158–160.
- ↑ Rasmussen, Pamela C; Anderton, John C (2005). Birds of South Asia, volume 2: Attributes and Status. Barcelona: Lynx Edicions. pp. 141–142. ISBN 978-84-87334-65-8.
- ↑ Rasmussen, P C (2005). "Biogeographic and conservation implications of revised species limits and distributions of South Asian birds". Zoologische Mededelingen 79–3 (13): 137–146.
- ↑ Davidson, D W H; Yeap Chin Aik (2010). Naturalist's Guide to the Birds of Malaysia and Singapore. Taunton, Somerset: John Beaufoy Publishing. p. 155. ISBN 978-1-906780-21-0.
- ↑ 16,0 16,1 16,2 16,3 16,4 Tavares, Erika S.; de Kroon, Gerard H.J.; Baker, Allan J. (2010). "Phylogenetic and coalescent analysis of three loci suggest that the Water Rail is divisible into two species, Rallus aquaticus and R. indicus". Evolutionary Biology 10 (226): 1–12. PMID 20653954. doi:10.1186/1471-2148-10-226.
- ↑ Boev, Zlatovar (2005). "Fossil birds in the National Museum of Natural History, Sofia: composition, development and scientific value" (PDF). Zoologische Mededelingen 79–3 (4): 35–44. Arquivado dende o orixinal (PDF) o 2011-08-15.
- ↑ Sánchez Marco, Antonio (2004). "Avian zoogeographical patterns during the Quaternary in the Mediterranean region and paleoclimatic interpretation". Ardeola 51 (1): 91–132.
- ↑ Lucas, Spencer G. (2002). Chinese fossil vertebrates. New York: Columbia University Press. p. 283. ISBN 978-0-231-08483-3.
- ↑ McMinn, M.; Palmer, M.; Alcover, Josep Antoni (2005). "A new species of rail (Aves: Rallidae) from the Upper Pleistocene and Holocene of Eivissa (Pityusic Islands, western Mediterranean)". Ibis 147 (4): 706–716. doi:10.1111/j.1474-919X.2005.00442.x.
- ↑ Alcover, Josep Antoni (2001). "Nous avenços en el coneixement dels ocells fòssils de les Balears" [New advances in the knowledge of bird fossils from the Balearic Islands]. Anuari Ornitològic de les Balears (en catalán) 16: 3–13.
- ↑ Kellner, Thomas; Krech, Mathias; Schulz, Axel; Müller, Carsten H.G. (2007). "The avifauna of Ibiza: an updated checklist including comments on abundances and ecology" (PDF). Rostocker Meeresbiologische Beiträge 18: 7–29.
- ↑ Jonsson, Lars (1994). Aves de Europa (en castelán). Barcelona: Omega. pp. 186–7. ISBN 84-282-1007-1.
- ↑ Dunning, John B. Jr., ed. (1992). CRC Handbook of Avian Body Masses. CRC Press. ISBN 978-0-8493-4258-5.
- ↑ 25,00 25,01 25,02 25,03 25,04 25,05 25,06 25,07 25,08 25,09 25,10 25,11 25,12 25,13 25,14 25,15 25,16 25,17 25,18 25,19 25,20 25,21 25,22 25,23 25,24 25,25 25,26 25,27 Taylor & van Perlo 2000, pp. 239–299
- ↑ Fuertes, Benito; García, Javier; Fernández, Juan; Suárez-Seoane, Susana; Arranz, Juan José (2010). "Can Iberian Water Rail Rallus aquaticus be sexed reliably using simple morphometrics?" (PDF). Ringing & Migration 25: 42–46. doi:10.1080/03078698.2010.9674413.
- ↑ 27,0 27,1 Ripley, S. Dillon; Beehler, Bruce M. (1985). Rails of the World, a compilation of new information 1975–1983 (Aves: Rallidae) (PDF). Smithsonian Contributions to Zoology (Washington, DC: Smithsonian Institution Press). p. 8.
- ↑ Stang, Alexandra T.; McRae, Susan B. (2008). "Why some rails have white tails: the evolution of white undertail plumage and anti-predator signaling" (PDF). Evolutionary Ecology 23 (6): 943–961. doi:10.1007/s10682-008-9283-z. Arquivado dende o orixinal (PDF) o 27 de xullo de 2011.
- ↑ Brown, Roy; Ferguson, John; Lawrence, Mike; Lees, David (1987). Tracks and Signs of the Birds of Britain and Europe. Bromley, Kent: Christopher Helm. p. 208. ISBN 978-0-7470-0201-7.
- ↑ Herremans, Marc (1990). "Body-moult and migration overlap in Reed Warblers (Acrocephalus scirpaceus) trapped during nocturnal migration". De Giervalk/Le Gerfaut 80: 149–158.
- ↑ 31,0 31,1 31,2 31,3 31,4 31,5 Ali, Salim; Ripley, S. Dillon (1980). Handbook of the Birds of India and Pakistan. Volume 2: Megapodes to Crab Plover (2nd ed.). New Delhi: OUP India. pp. 149–151. ISBN 978-0-19-565935-1.
- ↑ Sociedade Galega de Historia Natural (1995). Atlas de vertebrados de Galicia. Tomo II: aves. Santiago de Compostela: Consello da Cultura Galega. pp. 400–1. ISBN 84-87172-89-X.
- ↑ 33,0 33,1 33,2 33,3 33,4 33,5 33,6 Snow, David; Perrins, Christopher M., eds. (1998). The Birds of the Western Palearctic. volume 1 (concise ed.). Oxford: Oxford University Press. pp. 584–587. ISBN 978-0-19-854099-1.
- ↑ 34,0 34,1 Rasmussen, P.C. (2005). "Biogeographic and conservation implications of revised species limits and distributions of South Asian birds". Zoologische Mededelingen 79–3 (13): 137–146.
- ↑ de Kroon, Gerard H.J. (2004). "A comparison of two European breeding habitats of the Water Rail Rallus aquaticus". Acta Ornithologica 39 (1): 21–27. doi:10.3161/068.039.0107.
- ↑ de Kroon, Gerard H.J.; Mommers, Maria H.J. (2002). "Breeding of the Water Rail Rallus aquaticus in Cladium mariscus vegetation". Ornis Svecica 12: 69–74.
- ↑ Jenkins, Richard K.B.; Ormerod, Steve J. (2002). "Habitat preferences of breeding Water Rail Rallus aquaticus: Surveys using broadcast vocalizations during the breeding season found that Water Rail were significantly more abundant at sites that contained the most wet reed Phragmites sp". Bird Study 49 (1): 2–10. doi:10.1080/00063650209461238.
- ↑ 38,0 38,1 Virkkala, Raimo; Luoto, Miska; Heikkinen, Risto K.; Leikola, Niko (2005). "Distribution patterns of boreal marshland birds: modelling the relationships to land cover and climate". Journal of Biogeography 32 (11): 1957–1970. doi:10.1111/j.1365-2699.2005.01326.x.
- ↑ de Kroon, Gerard H.J.; Mommers, Maria H.J. (2003). "Why is the Water Rail Rallus aquaticus a very scarce breeder north of 61°N?". Ornis Svecica 13: 47–52.
- ↑ 40,0 40,1 40,2 40,3 40,4 Cocker, Mark; Mabey, Richard (2005). Birds Britannica. Londres: Chatto & Windus. pp. 175–177. ISBN 978-0-7011-6907-7.
- ↑ Celada, Claudio; Bogliani, Giuseppe (1993). "Breeding bird communities in fragmented wetlands". Italian Journal of Zoology 60 (1): 73–80. doi:10.1080/11250009309355794.
- ↑ Mullarney, Killian; Svensson, Lars; Zetterstrom, Dan; Grant, Peter (1999). Collins Bird Guide. Londres: Collins. p. 124. ISBN 978-0-00-219728-1.
- ↑ Jenkins, Richard K.B.; Buckton, S.T.; Ormerod, Steve J. (1995). "Local movements and population density of Water Rails Rallus aquaticus in a small inland reedbed". Bird Study 42 (1): 82–87. doi:10.1080/00063659509477152.
- ↑ 44,0 44,1 44,2 44,3 Coward 1930, pp. 319–321
- ↑ 45,0 45,1 45,2 45,3 Flegg, J.J.M.; Glue, David E. (1973). "A Water Rail study". Bird Study 20 (1): 69–80. doi:10.1080/00063657309476360.
- ↑ 46,0 46,1 Seebohm, Henry (1896). Coloured Figures of the Eggs of British Birds. Sheffield: Pawlson & Brailsford. p. 86.
- ↑ Jenkins, Richard K.B. (1999). "The breeding biology of the Water Rail Rallus aquaticus in Britain and Ireland". Bird Study 46 (3): 305–308. doi:10.1080/00063659909461143.
- ↑ 48,0 48,1 Lack, Peter, ed. (1986). The Atlas of Wintering Birds in Britain and Ireland. Calton, Staffordshire: T. & A.D. Poyser. pp. 172–173. ISBN 978-0-85661-043-1.
- ↑ Meade-Waldo, Edmund (1909). "The Water Rail". The Avicultural Magazine 7: 176.
- ↑ Yarrell, William (1894). A history of British birds. volume 3. Londres: J. van Voorst. pp. 25–26.
- ↑ Hansson, Bengt; Bensch, Staffan; Hasselquist, Dennis (2000). "Patterns of nest predation contribute to polygyny in the Great Reed Warbler". Ecology 81 (2): 319–328. ISSN 0012-9658. doi:10.1890/0012-9658(2000)081[0319:PONPCT]2.0.CO;2.
- ↑ Ciach, Michał (2007). "Interference competition between rails and crakes (Rallidae) during foraging in the post-breeding season" (PDF). Turkish Journal of Zoology 31: 161–163.
- ↑ Edwards & Bouchier 1991, p. 886
- ↑ de la Hey, Daniel Charles (2008). "The importance of birds in the diet of otter Lutra lutra on Shapwick Heath" (PDF). Bioscience Horizons 1 (2): 143–147. doi:10.1093/biohorizons/hzn018.
- ↑ Crisp, Edward (1856). "Observations on Strongylus filaria and Botaurus stellaris". Proceedings of the Zoological Society of London 24: 54.
- ↑ Coward 1930, p. 85
- ↑ Clarke, Roger; Bourgonje, André; Castelijns, Henk (1993). "Food niches of sympatric Marsh Harriers Circus aeruginosus and Hen Harriers C. cyaneus on the Dutch coast in winter". Ibis 135 (4): 424–431. doi:10.1111/j.1474-919X.1993.tb02115.x.
- ↑ Yalden, D.W. (1985). "Dietary separation of owls in the Peak District". Bird Study 32 (2): 122–131. doi:10.1080/00063658509476867.
- ↑ Glue, David E. (1977). "Feeding ecology of the Short-eared Owl in Britain and Ireland". Bird Study 24 (2): 70–78. doi:10.1080/00063657709476536.
- ↑ Bayle, Patrick; Prior, Richard (2006). "Prey species of Eagle Owl Bubo bubo in Lebanon". Sandgrouse 28 (2): 167–168.
- ↑ Alivizatos, Haralambos; Papandropoulos, Dimitris; Zogaris, Stamatis (2004). "Winter diet of the Greater Spotted Eagle (Aquila clanga) in the Amvrakikos wetlands, Greece". Journal of Raptor Research 38 (4): 371–374.
- ↑ Cavé, Antonius Johannes (1968). "The breeding of the kestrel, Falco tinnunculus L. in the reclaimed area Oostelijk Flevoland". Netherlands Journal of Zoology 18 (3): 313–407. doi:10.1163/002829668x00027.
- ↑ "Peregrines at Derby Cathedral" (PDF). Derbyshire Wildlife Trust, Derby Cathedral and Derby Museum & Art Gallery. Arquivado dende o orixinal (PDF) o 2 de outubro de 2011. Consultado o 18 de abril de 2011.
- ↑ Denny, Henry (1842). Monographia anoplurorum Britanniae or an essay on the British species of parasitic insects belonging to the order anoplura of leach. Londres: Henry G. Bohn. p. 139.
- ↑ Clay, Theresa; Hopkins, G.H.E. (1952). "The early literature on Mallophaga. Part 2. 1763–75". Bulletin of the British Museum (Natural History), Entomology 2: 1–42.
- ↑ Martyn, K.P. (1988). Provisional atlas of the ticks (Ixodoidea) of the British Isles (PDF). Grange-over-Sands, Cumbria: Institute of Terrestrial Ecology. p. 26. ISBN 978-1-870393-09-6.
- ↑ Hill, Dennis S. (1962). "A study of the distribution and host preferences of three species Of Ornithomyia (Diptera: Hippoboscidae) in the British Isles". Proceedings of the Royal Entomological Society of London A 37 (4–6): 37. doi:10.1111/j.1365-3032.1962.tb00286.x.
- ↑ Mizáková, A.; Gronesová, P.; Betáková, T. (2008). "Monitoring of influenza viruses in waterfowl and terrestrial birds in eastern Slovakia". Acta Virologica 52 (1): 71–73. PMID 18459840.
- ↑ Fereidouni, S.R.; Aghakhan, M.; Werner, O.; Starick, E.; Bozorghmehrifard, M.H. (2005). "Isolation and identification of avian influenza viruses from migratory birds in Iran". Veterinary Record 157 (17): 526. doi:10.1136/vr.157.17.526.
- ↑ Schwarzová, K.; Betáková, T.; Neméth, J.; Mizáková, A. (2006). "Detection of Borrelia burgdorferi sensu lato and Chlamydophila psittaci in throat and cloacal swabs from birds migrating through Slovakia" (PDF). Folia Microbiologica 51 (6): 653–658. PMID 17455806. doi:10.1007/BF02931634. Arquivado dende o orixinal (PDF) o 2011-10-02.
- ↑ Palma, Ricardo L.; Jensen, Jens-Kjeld (2005). "Lice (Insecta: Phthiraptera) and their host associations in the Faroe Islands" (PDF). Steenstrupia 29 (1): 49–73.
- ↑ Dronen, Norman O.; Blend, Charles K. (2007). "Ophthalmophagus bucephali n. sp. (Digenea: Cyclocoelidae) from the American Goldeneye, Bucephala clangula americana (Anatidae), from the Central Flyway of North America and a Checklist of Goldeneye Parasites". Comparative Parasitology 74 (1): 48–74. doi:10.1654/4221.1.
- ↑ Atyeo, Warren T.; Peterson, Paul C. (1976). "The feather mite genera Zumptia Gaud & Mouchet and Parazumptia gen. nov. (Acarina, Analgoidea)" (PDF). Tijdschrift voor Entomologie 119: 327–335. Arquivado dende o orixinal (PDF) o 2011-08-12.
- ↑ Sakamoto, T.; Sarashina, T. (1968). "Strongyloides avium Cram, 1929 from Rallus aquaticus indicus Blyth" (PDF). Japanese Journal of Veterinary Research 16 (1): 44–47. PMID 5304170. Arquivado dende o orixinal (PDF) o 2012-03-08. Consultado o 2011-04-19.
- ↑ Uchida, Seinosuke (1948). "Studies on the biting-lice (Mallophaga) of Japan and adjacent territories (Suborder Ischnocera Pt. I" (PDF). Japanese Medical Journal 1 (4): 303–306. doi:10.7883/yoken1948.1.303.
- ↑ Moore, N.P.; Roy, S.S.; Helyar, A. (2003). "Mink (Mustela vison) eradication to protect ground-nesting birds in the Western Isles, Scotland, United Kingdom". New Zealand Journal of Zoology 30 (4): 443–452. doi:10.1080/03014223.2003.9518351.
- ↑ "Outer Hebrides Biosecurity Plan 2010–2015" (PDF). Outer Hebrides Fisheries Trust. Arquivado dende o orixinal (PDF) o 19 de xaneiro de 2012. Consultado o 21 de abril de 2011.
- ↑ "The Natural Heritage of The Western Isles What Can You Do To Help Shape Its Future? – Consultation draft" (PDF). Scottish Natural Heritage. marzo de 2001. Arquivado dende o orixinal (PDF) o 4 de maio de 2004. Consultado o 21 de abril de 2011.
- ↑ "American mink 'safe haven' project under way". BBC News – Scotland (BBC). 12 de maio de 2011. Consultado o 12 de maio de 2011.
- ↑ Gibbons, David Wingfield; Reid, James B.; Chapman, Robert A., eds. (1993). The New Atlas of Breeding Birds in Britain and Ireland: 1988–91. Calton, Staffordshire: T. & A.D. Poyser. pp. 146–147. ISBN 978-0-85661-075-2.
- ↑ Carpenè, E.; Serra, R.; Isani, G. (1995). "Heavy metals in some species of waterfowl of northern Italy". Journal of Wildlife Diseases 31 (1): 49–56. PMID 7563424. doi:10.7589/0090-3558-31.1.49.
- ↑ Boev, Zlatovar (2006). Gamefowl in Bulgaria over the last 8,000 years. pp. 398–389. in Botev, Nicola, ed. (1996). Proceedings of the 22nd Congress of the International Union of Game Biologists 1995: The game and the man. Sofia: Pensoft Publishers. ISBN 978-954-642-013-8.
- ↑ Allason-Jones, Lindsay (2005). Women in Roman Britain. York: Council for British Archaeology. p. 103. ISBN 978-1-902771-43-4.
- ↑ Grimm, Jessica M. (2010). "A bird for all occasions. The use of birds at the Romano-British sanctuary of Springhead, Kent, UK": 187–195. in Prummel, W.; Zeiler, J.T.; Brinkhuizen, D.C. (2010). Birds in Archaeology: Proceedings of the 6th Meeting of the ICAZ Bird Working Group in Groningen 23.8–27.8.2008. Groningen Archaeological Studies, 12. Eelde: Barkhuis. ISBN 978-90-77922-77-4.
- ↑ Watson, George E. (2002). Birds: evidence from wall paintings sculpture, skeletal remains, and ancient authors. pp. 360, 394. en Jashemski, Wilhelmina Mary Feemster; Meyer, Frederick Gustav (2002). The natural history of Pompeii. Cambridge: Cambridge University Press. ISBN 978-0-521-80054-9.
- ↑ Serjeantson, Dale (2006). The consumption and supply of birds in Late Medieval England. pp. 131–147. in Woolgar, C.M.; Serjeantson, Dale; Waldron, Tony (2006). Food in medieval England: diet and nutrition. Oxford: OUP. ISBN 978-0-19-927349-2.
Véxase tamén editar
| Wikimedia Commons ten máis contidos multimedia na categoría: Rascón de auga |
| Wikispecies posúe unha páxina sobre: Rascón de auga |
Outros artigos editar
Bibliografía editar
- Penas Patiño, Xosé M.; Pedreira López, Carlos (2004). Guía das aves de Galicia. Ilustrado por Calros Silvar. Baía Edicións. ISBN 84-96128-69-5.
- Sociedade Galega de Historia Natural (1995). Atlas de vertebrados de Galicia. Tomo II: aves. Santiago de Compostela: Consello da Cultura Galega. ISBN 84-87172-89-X.
- Coward, Thomas Alfred (1930). The Birds of the British Isles and their eggs (two volumes). Londres: Frederick Warne.
- Taylor, Barry; van Perlo, Berl (2000). Rails. Robertsbridge, Sussex: Pica. ISBN 978-1-873403-59-4.
Ligazóns externas editar
- Ageing and sexing de Javier Blasco-Zumeta & Gerd-Michael Heinze (PDF, 5.2 MB)
- Folla de datos de BirdLife species para Rallus aquaticus
- {{{2}}} en Avibase
- Vídeos, fotos, e sons de Rascón de auga na Internet Bird Collection
- Galería de fotos de Rascón de auga en VIREO (Universidade de Drexel)
- Mapa interactivo da área de distribución de Rallus aquaticus en IUCN Red List maps
- Rallus-aquaticus - Gravacións de sons de Water rail en Xeno-canto.