Raio atómico
O raio atómico é a distancia entre o núcleo do átomo e o electrón estable máis afastado do mesmo. Adóitase medir en picómetros (1 pm=10–12 m) ou Ángstroms (1 Å=10–10 m).
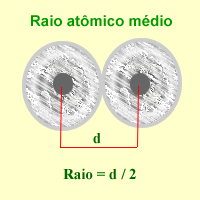
Ao ser os núcleos e os electróns partículas cuánticas, sometidas ao principio de indeterminación ou incerteza de Heisenberg, as medidas directas de distancias non poden ter senón un significado estatístico. Convencionalmente, defínese como a metade da distancia existente entre os centros de dous átomos enlazados, e dependendo dese enlace poderemos falar de raios atómicos, iónicos, metálicos ou raios de van der Waals.
En función do tipo de enlace químico defínense tamén outros raios como o covalente (xeralmente para elementos non metálicos) e o iónico (para elementos metálicos). Situados agora na táboa periódica, unha sinxela regra mnemotécnica para recordar o modo en que aumenta o raio atómico é a seguinte:
O raio atómico dun elemento aumenta de arriba a abaixo e de dereita a esquerda na táboa periódica dos elementos.