Nó de cistina
O nó de cistina é un motivo estrutural presente nalgunhas proteínas que contén tres pontes disulfuro (formadas por parellas de moléculas do aminoácido cisteína). As seccións do polipéptido que aparecen entre dúas delas forman un bucle a través do cal pasa unha terceira ponte disulfuro, formando unha subestrutura rotaxano. Aparece en moitas proteínas de moitas especies e proporciona unha considerable estabilidade estrutural.[2] Hai tres tipos de nó de cistina, que se diferencian na topoloxía dos enlaces disulfuro, que son:[3]
- O Nó de Cistina de Factor de Crecemento (GFCK)
- O Nó de Cistina Inhibidor (ICK) común en toxinas de arañas e certos caracois
- O Nó de Cistina Cíclico, ou ciclótido.
| Nó de cistina | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
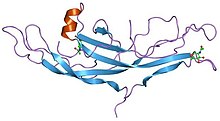 Estrutura da gonadotropina coriónica humana.[1] | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Cys_knot | ||||||||||
| Pfam | PF00007 | ||||||||||
| Pfam clan | CL0079 | ||||||||||
| InterPro | IPR006208 | ||||||||||
| SCOPe | 1hcn / SUPFAM | ||||||||||
| |||||||||||
O nó de cistina de factor de crecemento (GFCK) descubriuse primeiro na estrutura do factor de crecemento dos nervios, e foi resolto por cristalografía de raios X e publicado en 1991 por Tom Blundell.[4] Todas as estruturas de GFCK que se determinaron son diméricas, pero os seus modos de dimerización en diferentes clases son distintos.[5]
Notas editar
- ↑ Wu H, Lustbader JW, Liu Y, Canfield RE, Hendrickson WA (xuño de 1994). "Structure of human chorionic gonadotropin at 2.6 A resolution from MAD analysis of the selenomethionyl protein". Structure 2 (6): 545–58. PMID 7922031. doi:10.1016/s0969-2126(00)00054-x.
- ↑ "Cystine Knots". Arquivado dende o orixinal o 05 de febreiro de 2015. Consultado o 13 de febreiro de 2015.
- ↑ Daly, N. L.; Craik, D. J. (2011). "Bioactive cystine knot proteins". Current Opinion in Chemical Biology 15 (3): 362–368. doi:10.1016/j.cbpa.2011.02.008. PMID 21362584.
- ↑ PDB 1bet; McDonald NQ, Lapatto R, Murray-Rust J, Gunning J, Wlodawer A, Blundell TL (decembro de 1991). "New protein fold revealed by a 2.3-A resolution crystal structure of nerve growth factor". Nature 354 (6352): 411–4. PMID 1956407. doi:10.1038/354411a0.
- ↑ Jiang X, Dias JA, He X (Aug 2013). "Structural biology of glycoprotein hormones and their receptors: Insights to signaling". Mol Cell Endocrinol 382 (1): 424–51. PMID 24001578. doi:10.1016/j.mce.2013.08.021.