Hidroxiprolina
A (2S,4R)-4-hidroxiprolina ou L-hidroxiprolina (C5H9O3N), é un aminoácido non proteinoxénico común, abreviado como HYP ou Hyp (en Protein Data Bank e outros sitios). Orixínase por hidroxilación do aminoácido prolina.
| Hidroxiprolina | |
|---|---|
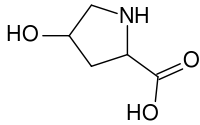 | |
ácido (2S,4R)-4-hidroxipirrolidina-2-carboxílico | |
| Identificadores | |
| Número CAS | 51-35-4 |
| PubChem | 825 |
| UNII | RMB44WO89X |
| MeSH | Hydroxyproline |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C5H9NO3 |
| Masa molecular | 131,13 g·mol−1 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Estrutura e descubrimento editar
En 1902, Hermann Emil Fischer illou a hidroxiprolina dun hidrolizado de xelatina. En 1905, Hermann Leuchs sintetizou unha mestura racémica de 4-hidroxiprolina.[1]
A hidroxiprolina difire da prolina en que presenta un grupo hidroxilo (OH) unido ao átomo de carbono gamma.
Produción e función editar
A hidroxiprolina orixínase por hidroxilación do aminoácido prolina catalizada polo encima prolil hidroxilase, que se realiza despois da síntese da proteína, polo que se trata dunha modificación postraducional. Esta reacción ten lugar no lume do retículo endoplasmático. Aínda que non se incorpora directamente ás proteínas, xa que non está codificada no código xenético, a hidroxiprolina supón aproximadamente o 4% de todos os aminoácidos dun tecido animal, unha cantidade que supera á de sete aminoácidos proteinoxénicos que se incorporan durante a tradución da proteína.[2]
A hidroxiprolina é un compoñente principal da proteína coláxeno.[3] A hidroxiprolina e a prolina xogan papeis chaves na estabilidade do coláxeno.[4] Permiten que se produza o enrolamento característico da hélice de coláxeno (distinto do das hélices alfa típicas).[5] Na tríade canónica do coláxeno Xaa-Yaa-Gly (onde Xaa e Yaa representan a calquera aminoácido), unha prolina que ocupe a posición Yaa hidrolízase para orixinar a secuencia Xaa-Hyp-Gly. Esta modificación do residuo de prolina incrementa a estabilidade da tripla hélice do coláxeno. Propúxose inicialmente que a estabilización era debida a que moléculas de auga formaban unha rede de enlaces de hidróxeno que unían os grupos prolil hidroxil e os grupos carbonil da cadea principal.[6] Posteriormente, viuse que o incremento de estabilidade debíase principalmente a un efecto estereoelectrónico e que a hidración dos residuos de hidroxiprolina proporcionaba pouca ou ningunha estabilidade adicional.[7] Ademais do coláxeno, outras proteínas de mamífero conteñen hidroxiprolina, entre as que están a elastina e a argonauta 2, as cales presentan dominios de tipo coláxeno, onde se encontra hidroxiprolina. Algúns velenos de gasterópodos mariños, chamados conotoxinas, conteñen hidroxiprolina, pero non teñen secuencias de tipo coláxeno.[2]
A hidroxilación da prolina está implicada na unión da subunidade alfa (HIF-1 alfa) do factor inducible por hipoxia (HIF) para a degradación por proteólise. En situación de normoxia (condicións normais de oxíxeno) a proteína EGLN1[1] hidroxila a prolina na posición 564 da HIF-1 alfa, o cal permite a ubiquitilación polo supresor de tumores von Hippel-Lindau (pVHL) e o marcado para a degradación polo proteasoma.[8]
Como a hidroxiprolina se encontra principalmente no coláxeno, o contido de hidroxiprolina foi utilizado como un indicador para determinar as cantidades de coláxeno e/ou xelatina.
As glicoproteínas ricas en hidroxiprolina encóntranse en paredes celulares de plantas.[9]
Importancia médica editar
A hidroxilación da prolina precisa ácido ascórbico (vitamina C). Os primeiros e máis obvios efectos (problemas de xenxivas e pelo) da falta de vitamina C no corpo humano débense a defectos na hidroxilación dos residuos prolina no coláxeno, o que reduce a estabilidade química do coláxeno, e causa o escorbuto.
Na enfermidade de Paget dos ósos prodúcese un aumento dos niveis de hidroxiprolina no soro sanguíneo ou nos ouriños.[10]
Outras hidroxiprolinas editar
Na natureza existen outros isómeros da hidroxiprolina, entre os que están a 2,3-cis-, 3,4-trans-, e 3,4-dihidroxiprolina, que se atopan en paredes celulares de diatomeas[11] e crese que teñen unha función na deposición do sílice na parede. A hidroxiprolina tamén se encontra nas paredes celulares de oomicetos, que son protistas similares a fungos relacionados coas diatomeas.[12] A (2S,4S)-cis-4-hidroxiprolina encóntrase nos péptidos cíclicos tóxicos dos fungos do xénero Amanita, como por exemplo a alfa-amanitina e a faloidina.[13]
Notas editar
- ↑ R.H.A. Plimmer (1912) [1908]. R.H.A. Plimmer & F.G. Hopkins, ed. The chemical composition of the proteins. Monographs on biochemistry. Part I. Analysis (2nd ed.). London: Longmans, Green and Co. p. 132. Consultado o January 18, 2010.
- ↑ 2,0 2,1 Gorres, Kelly L.; Raines, Ronald T. (2010). "Prolyl 4-hydroxylase". Critical Reviews in Biochemistry and Molecular Biology 45 (2): 106–124. PMC 2841224. PMID 20199358. doi:10.3109/10409231003627991.
- ↑ Szpak, Paul (2011). "Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis". Journal of Archaeological Science 38 (12): 3358–3372. doi:10.1016/j.jas.2011.07.022. Arquivado dende o orixinal o 18 de xaneiro de 2012. Consultado o 25 de maio de 2013.
- ↑ Nelson, D. L. and Cox, M. M. (2005) Lehninger's Principles of Biochemistry, 4th Edition, W. H. Freeman and Company, New York.
- ↑ Brinckmann, J., Notbohm, H. and Müller, P.K. (2005) Collagen, Topics in Current Chemistry 247, Springer, Berlin.
- ↑ Bella, J; Eaton, M; Brodsky, B; Berman, HM (1994). "Crystal and molecular structure of a collagen-like peptide at 1.9 A resolution". Science 266 (5182): 75–81. PMID 7695699. doi:10.1126/science.7695699.
- ↑ Kotch, F.W.; Guzei, I.A.; Raines, R.T. (2008). "Stabilization of the Collagen Triple Helix by O-Methylation of Hydroxyproline Residues". Journal of the American Chemical Society 130 (10): 2952–2953. PMC 2802593. PMID 18271593. doi:10.1021/ja800225k.
- ↑ Jaakkola, P.; Mole, D.R.; Tian, Y.M.; Wilson, M.I.; Gielbert, J.; Gaskell, S.J.; Kriegsheim, A.V.; Hebestreit, H.F.; Mukherji, M.; et al. (2001). "Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation". Science 292 (5516): 468–72. PMID 11292861. doi:10.1126/science.1059796.
- ↑ Annu. Rev. Plant Physiol. Plant Mol. Biol. 1998. 49:281–309 PLANT CELL WALL PROTEINS Gladys I. Cassab
- ↑ http://www.wheelessonline.com/ortho/pagets_disease
- ↑ Nakajima, T.; Volcani, B.E. (1969). "3,4-Dihydroxyproline: a new amino acid in diatom cell walls". Science 164 (3886): 1400–1401. PMID 5783709. doi:10.1126/science.164.3886.1400.
- ↑ Alexopoulos, C.J., Mims C.W. and Blackwell, M. (1996). Introductory Mycology (4th ed.). New York: John Wiley & Sons. pp. 687–688. ISBN 0-471-52229-5.
- ↑ Wieland, T. (1986). Peptides of Poisonous Amanita Mushrooms. Springer.