Hidroquinona
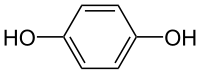
A hidroquinona, tamén chamada 1,4-dihidroxibenceno, benceno-1,4-diol ou quinol, é un composto orgánico aromático que é un tipo de fenol, un derivado de benceno, coa fórmla química C6H4(OH)2. Ten dous grupos hidroxilo enlazados covalentemente a un anel bencénico en posición para. É un sólido branco granular. Os derivados substituídos deste composto parental tamén se denominan hidroquinonas. O nome "hidroquinona" acuñouno Friedrich Wöhler en 1843.[6]
| Hidroquinona | |
|---|---|
 | |
 | |
 | |
| Identificadores | |
| Número CAS | 123-31-9 |
| PubChem | 785 |
| ChemSpider | 764 |
| UNII | XV74C1N1AE |
| Número UN | 3077, 2662 |
| DrugBank | DB09526 |
| KEGG | D00073 |
| ChEBI | CHEBI:17594 |
| ChEMBL | CHEMBL537 |
| Número RTECS | MX3500000 |
| Referencia Beilstein | 605970 |
| Referencia Gmelin | 2742 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H6O2 |
| Masa molar | 110,11 g mol−1 |
| Aspecto | Sólido branco |
| Densidade | 1,3 g cm−3, sólido |
| Punto de fusión | 172 °C; 342 °F; 445 K |
| Punto de ebulición | 287 °C; 549 °F; 560 K |
| Solubilidade en auga | 5,9 g/100 mL (15 °C) |
| Presión de vapor | 10-5 mmHg (20 °C)[2] |
| Acidez (pKa) | 9,9[3] |
| -64,63·10-6 cm3/mol | |
| Estrutura | |
| Momento dipolar | 1,4 ± 0,1 D[4] |
| Perigosidade | |
| Pictogramas GHS | 
|
| Palabra sinal GHS | Danger (Perigo) |
| NFPA 704 | |
| Punto de inflamabilidade | 165 °C; 329 °F; 438 K |
| LD50 | 490 mg/kg (mamífero, oral) 245 mg/kg (rato, oral) 200 mg/kg (coello, oral) 320 mg/kg (rata, oral) 550 mg/kg (coello de Indias, oral) 200 mg/kg (can, oral) 70 mg/kg (gato, oral)[5] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Produción editar
A hidroquinona prodúcese industrialmente de dúas maneiras:[7]
- A ruta máis amplamente utilizada é similar ao mecanismo de reacción do proceso do cumeno e implica a dialquilación do benceno con propeno para dar lugar a 1,4-diisopropilbenceno. Este composto reacciona co aire para orixinar o bis(hidroperóxido), que é estruturalmente similar ao hidroperóxido de cumeno e rearránxase en ácido para dar acetona e hidroquinona.[8]
- Unha segunda ruta implica a hidroxilación do fenol nun catalizador. A conversión usa peróxido de hidróxeno e forma unha mestura de hidroquinona e o seu isómero orto catecol (benceno-1,2-diol):
Outros métodos menos comúns son:
- Propúxose unha síntese potencialmente significativa de hidroquinona a partir de acetileno e pentacarbonilo de ferro[9][10][11][12][13][14] O pentacarbonilo de ferro seve como catalizador en vez de como reactivo, en presenza do gas monóxido de carbono libre. O rodio ou o rutenio poden substituír o ferro como catalizadores cuns rendementos químicos favorables, pero non se usan normalmente debido ao seu custo de recuperación da mestura de reacción.[9]
- Poden prepararse tamén hidroquinona e os seus derivados por oxidación de varios fenois. Exemplos son a oxidación de persulfato de Elbs e a oxidación de Dakin.
- A hidroquinona obtivérona primeiro en 1820 os químicos franceses Pelletier e Caventou por medio da destilación seca de ácido quínico.[15]
Reaccións editar
A reactividade dos grupos hidroxilo da hidroquinona lembra a doutros fenois, e é feblemente ácida. A base conxugada resultante sofre unha fácil O-alquilación para producir mono- e diéteres. De xeito similar, a hidroquinona é moi susceptible a substitucións no anel por reaccións de Friedel-Crafts, como a alquilación. Esta reacción é aproveitada para formar antioxidantes moi usados como o 2-ter-butil-4-metoxifenol (BHA). A útil tinguidura quinizarina prodúcese por diacilación de hidroquinona con anhídrido ftálico.[7]
Redox editar
A hidroquinona sofre oxidación en condicións suaves para dar benzoquinona. Este proceso pode ser revertido. Algúns derivados de hidroquinonas naturais mostran este tipo de reactividade, un exemplo é o coencima Q. Industrialmente esta reacción aprovéitase tanto coa propia hidroquinona coma, máis a miúdo, cos seus derivados nos que un OH foi substituído por unha amina.
Cando se cocristalizan a hidroquinona incolora e a benzoquinona, un sólido vivamente amarelo, nunha proporción de 1:1, fórmase un complexo de transferencia de carga verde escuro cristalino (punto de fusión 171 °C) chamado quinhidrona (C
6H
6O
2·C
6H
4O
2). Este complexo disólvese en auga quente, onde as dúas moléculas se disocian en solución.[16]
Aminación editar
Unha importante reacción é a conversión da hidroquinona aos derivados mono- e diamina. O metilaminofenol, usado en fotografía, prodúcese deste modo:[7]
As diaminas, útiles na industria do caucho como axentes antiozono, son producidos de xeito semellante a partir de anilina:
Usos editar
A hidroquinona ten diversos usos principalmente asociados coa súa acción como axente redutor que é soluble en auga. É un compoñente principal na maioría dos reveladores fotográficos en branco e negro para película e papel onde, co composto metol, reduce os haluros de prata a prata elemental.
Hai outros diversos usos asociados co seu poder redutor. Como inhibidor da polimerización, ao aproveitar as súas propiedades antioxidantes, a hidroquinona impide a polimerización de ácido acrílico, metil metacrilato, cianoacrilato e outros monómeros que son susceptibles á polimerización iniciada por radicais. Ao actuar como eliminador de radicais libres, a hidroquinona serve para prolongar a data de caducidade des resinas sensibles á luz como polímeros precerámicos.[17]
A hidroquinona pode perder un catión hidróxeno de ambos os grupos hidroxilo para formar un ión difenolato. O sal difenolato de disodio da hidroquinona utilízase como unha unidade comonómera alternante na produción do polímero PEEK.
Despigmentación da pel editar
A hidroquinona utilízase como unha aplicación tópica para o branqueamento da pel para reducir a cor da pel. Non ten a mesma predisposición a causar dermatite que o metol. É un produto que só se dispensa por prescriciónn médica nalgúns países, incluíndo os países da Unión Europea nos que rexe a directriz 76/768/EEC:1976.[18][19]
En 2006, a FDA dos Estados Unidos revocou a súa previa aprobación da hidroquinona e propuxo unha prohibición de todas as preparacións vendidas sen receita.[20] A FDA prohibiu oficialmene a hidroquinona en 2020 como parte dunha reforma maior do proceso de revisión dos fármacos vendidos sen necesidade de receita.[21] A FDA afirmou que a hidroquinona non pode ser descartada como carcinóxeno potencial.[22] Chegouse a esta conclusión baseándose no grao de absorción en humanos e a incidencia de neoplasmas en ratas en varios estudos onde as ratas adultas tiñan unha maior taxa de tumores, incluíndo as hiperplasias de célula folicular tiroide, anisocariose (variación no tamaño dos núcleos), leucemia de célula mononuclear, adenomas hepatocelulares e adenoma de células tubulares renais. A Campaña por Cosméticos Sans tamén salientou algunhas destas preocupacións.[23]
Numerosos estudos revelaron que a hidroquinona tomada oralmente, pode causar ocronose exóxena, unha enfermidade desfigurante na cal se depositan pigmentos biolóxicos negros azulados na pel; porén, as preparacións para a pel que conteñen o ingrediente son aplicadas topicamente. A FDA clasificara a hidroquinona en 1982 como produto seguro, xeralmente recoñecido como seguro e efectivo (GRASE), porén suxeríronse estudos adicionais baixo o Programa de Toxicoloxía Nacional para determinar se hai un risco para os humanos polo uso da hidroquinona.[20][24][22] A avaliación do Programa de Toxicoloxía Nacional mostrou algunhas evidencias de efectos carcinoxénicos e xenotóxicos a longo prazo.[25]
Aínda que a hidroquinona segue sendo moi receitada para o tratamento da hiperpigmentación, as axencias regulatorias da Unión Europea, Xapón e EUA formularon reservas sobre a súa seguridade promovendo a investigación doutros axentes con eficacia comparable.[26] Varios deses produtos están agora investigándose ou xa dispoñibles,[27] como o ácido azelaico,[28] o ácido kójico, os retinoides, a cisteamina,[29] esteroides tópicos o ácido glicólico e outras substancias. Unha destas, o 4-butilresorcinol, demostrou ser máis efectivo no tratamento de trastornos da melanina da pel por unha ampla marxe, así como o suficientemente seguro como para poder venderse sen receita médica.[30]
Distribución natural editar
As hidroquinonas son un dos dous reactivos primarios que hai nas glándulas defensivas dos escaravellos bombardeiros, xunto co peróxido de hidróxeno (e quizais outros compostos, dependendo da especie), que se acumulan nun depósito. Este depósito ou reservorio abre por medio dunha válvula controlada por músculos nunha cámara de reacción de paredes grosas. Esta cámara está tapizada con células que segregan catalases e peroxidases. Cando o contido do depósito é forzado a pasar á cámara de reacción, as catalases e peroxidases rapidamente descompoñen o peróxido de hidróxeno e catalizan a oxidación das hidroquinonas en p-quinonas. Estas reaccións liberan oxíxeno libre e xeran suficiente calor para levar a mestura ao punto de ebulición á vez que se vaporiza aproximadamente unha quinta parte do contido, producindo un spray quente que sae do abdome do escaravello.[31]
Pénsase que a hidroquinona é a toxina activa nos cogomelos Agaricus hondensis.[32]
A hidroquinona é un dos constituíntes químicos do produto natural própole.[33]
É tamén un dos compostos químicos que se encontra no castóreo. Este composto acumúlase nuns sacos que teñen os castores na zona anal, xunto cunhas glándulas anais. Estes utilízano para marcar o seu territorio, xunto coa urina.[34]
Notas editar
- ↑ 1,0 1,1 "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 691. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ↑ NIOSH Pocket Guide to Chemical Hazards. "#0338". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Hydroquinone" (PDF). OECD SIDS. UNEP Publications. Arquivado dende o orixinal (PDF) o 2016-10-20. Consultado o 2018-09-17.
- ↑ Lander, John J.; Svirbely, John J. Lander, W. J. (1945). "The Dipole Moments of Catechol, Resorcinol and Hydroquinone". Journal of the American Chemical Society 67 (2): 322–324. doi:10.1021/ja01218a051.
- ↑ "Hydroquinone". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ↑ F. Wöhler (1844) "Untersuchungen über das Chinon" (Investigations of quinone), Annalen der Chemie und Pharmacie, 51 : 145-163. From page 146: "Das so erhaltene Destillat … enthält … einen neuen, krystallisierenden Körper, den ich unter dem Namen farbloses Hydrochinon weiter unten näher beschreiben werde." (O destilado así obtido … contén … unha nova substancia cristalizable que describirei, co nome hidroquinona incolora, máis abaixo en maior detalle.) [Nota: a fórmula empírica de Wöhler para a hidroquinona (p. 152) é incorrecta porque (1) el atribuíulle á molécula 25 (en vez de 24) átomos de carbono, e (2) como facían moitos químicos daquel tempo, usaba masas atómicas incorrectas para o carbono (6 en vez de 12) e o oxíxeno (8 en vez de 16). Con estas correccións, a súa fórmula empírica queda así: C12H12O4. Dividindo os subíndices por 2, o resultado é: C6H6O2, que é correcto.]
- ↑ 7,0 7,1 7,2 Phillip M. Hudnall "Hydroquinone" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. 2005 Wiley-VCH, Weinheim. doi 10.1002/14356007.a13_499.
- ↑ Gerhard Franz, Roger A. Sheldon "Oxidation" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000 doi 10.1002/14356007.a18_261
- ↑ 9,0 9,1 Reppe, Walter; Kutepow, N; Magin, A (1969). "Cyclization of Acetylenic Compounds". Angewandte Chemie International Edition in English 8 (10): 727–733. doi:10.1002/anie.196907271.
- ↑ Hubel, Karl; Braye, Henri (1960). Process for the preparation of substituted cyclic compounds and products resulting therefrom US3149138 A (PDF). Union Carbide Corp.
- ↑ Pino, Piero; Braca, Giuseppe; Sbrana, Glauco (1964). Preparation of hydroquinone US3355503 A (PDF). Lonza Ag.
- ↑ Walter, Reppe; Magin, August (1966). Production of hydroquinones US3394193 A (PDF). Basf Ag.
- ↑ Piero, Pino; Giuseppe, Braca; Frediano, Settimo; Glauco, Sbrana (1967). Preparation of hydroquinone US3459812 A (PDF). Lonza Ag.
- ↑ Holmes, J.; Hagemeyer, H. (1971). Process for the production of hydroquinone US 3742071 A (PDF). Eastman Kodak Co.
- ↑ Ver:
- Pelletier and Caventou (1820) "Recherches chimiques sur les quinquinas" (Chemical investigations of quinquinas [i.e., the bark of various Cinchona trees]), Annales de Chimie et de Physique, 2nd series, 15 : 289-318, 337-364. Nas páxinas 341-342 discútense a preparación e propiedades de l'acide pyro-kinique (ácido piroquínico ou hidroquinona).
- Roscoe, Henry (1891). A Treatise on Chemistry, Volume 3, Part 3. Londres: Macmillan & Co. p. 165.
- ↑ Streitwieser, Andrew (1992). Introduction to organic chemistry. Heathcock, Clayton H., 1936-, Kosower, Edward M. (4th ed.). Upper Saddle River, N.J.: Prentice Hall. ISBN 978-0139738500. OCLC 52836313.
- ↑ Additive manufacturing of ceramics from preceramic polymers Additive manufacturing 2019 vol. 27. pp 80-90
- ↑ 76/768/EEC:1976 Council Directive 76/768/EEC of 27 de xullo de 1976 on the approximation of the laws of the Member States relating to cosmetic products : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=CELEX:31976L0768:EN:HTML
- ↑ "Clear N Smooth Skin Toning Cream recalled". 2011-10-04. Consultado o 4 de abril de 2018.
- ↑ 20,0 20,1 United States Food and Drug Administration (2006). Skin Bleaching Drug Products for Over-the-Counter Product Use; Proposed Rule (PDF) (Informe). 1978N-0065. Arquivado dende o orixinal (PDF) o 2011-05-16.
- ↑ "Congress Enacts OTC Monograph Reform". JD Supra (en inglés). Consultado o 2021-12-19.
- ↑ 22,0 22,1 Research, Center for Drug Evaluation and. "About the Center for Drug Evaluation and Research - Hydroquinone Studies Under The National Toxicology Program (NTP)". www.fda.gov (en inglés). Arquivado dende o orixinal o 2017-01-22. Consultado o 2017-02-12.
- ↑ Campaign For Safe Cosmetics - Hydroquinone Arquivado 2010-11-27 en Wayback Machine.
- ↑ Olumide, YM; Akinkugbe, AO; Altraide, D; Mohammed, T; Ahamefule, N; Ayanlowo, S; Onyekonwu, C; Essen, N (abril de 2008). "Complications of chronic use of skin lightening cosmetics". International Journal of Dermatology 47 (4): 344–53. PMID 18377596. doi:10.1111/j.1365-4632.2008.02719.x.
- ↑ "Hydroquinone 10022-H". ntp.niehs.nih.gov (en inglés). Arquivado dende o orixinal o 2017-10-01. Consultado o 2017-02-12.
- ↑ Draelos, Zoe Diana (2007-09-01). "Skin lightening preparations and the hydroquinone controversy". Dermatologic Therapy 20 (5): 308–313. ISSN 1529-8019. PMID 18045355. doi:10.1111/j.1529-8019.2007.00144.x.
- ↑ Bandyopadhyay, Debabrata (2009-01-01). "Topical treatment of melasma". Indian Journal of Dermatology 54 (4): 303–309. ISSN 0019-5154. PMC 2807702. PMID 20101327. doi:10.4103/0019-5154.57602.
- ↑ Mazurek, Klaudia; Pierzchała, Ewa (2016-09-01). "Comparison of efficacy of products containing azelaic acid in melasma treatment". Journal of Cosmetic Dermatology 15 (3): 269–282. ISSN 1473-2165. PMID 27028014. doi:10.1111/jocd.12217.
- ↑ Mansouri, P.; Farshi, S.; Hashemi, Z.; Kasraee, B. (2015-07-01). "Evaluation of the efficacy of cysteamine 5% cream in the treatment of epidermal melasma: a randomized double-blind placebo-controlled trial". The British Journal of Dermatology 173 (1): 209–217. ISSN 1365-2133. PMID 25251767. doi:10.1111/bjd.13424.
- ↑ "Hydroquinones". Phenols—Advances in Research and Application: 2013 Edition. Scholastic. 2013. p. 76.
- ↑ Organic Chemistry, Solomon and Fryhle, 10th edition, Wiley Publishing, 2010.[cómpre nº de páxina]
- ↑ Joval, E; Kroeger, P; N (abril de 1996). "Hydroquinone: the toxic compound of Agaricus hondensis". Planta Medica 62 (2): 185. PMID 17252436. doi:10.1055/s-2006-957852.
- ↑ Burdock, G.A. (1998). "Review of the biological properties and toxicity of bee propolis (propolis)". Food and Chemical Toxicology 36 (4): 347–363. PMID 9651052. doi:10.1016/S0278-6915(97)00145-2.
- ↑ The Beaver: Its Life and Impact. Dietland Muller-Schwarze, 2003, page 43 (libro en Google books)
Véxase tamén editar
Ligazóns externas editar
- "Hydroquinone". Drug Information Portal. U.S. National Library of Medicine.
- International Chemical Safety Card 0166
- NIOSH Pocket Guide to Chemical Hazards



