Sinaptobrevina
As sinaptobrevinas (isotipos de sinaptobrevina 1-2) son pequenas proteínas integrais de membrana de vesículas con pesos moleculares de 18 kDa, que forman parte da familia da proteína de membrana asociada a vesículas (VAMP). As VAMP1 e VAMP2 son sinaptobrevinas.[1][2][3][4][5]
| Synaptobrevin | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
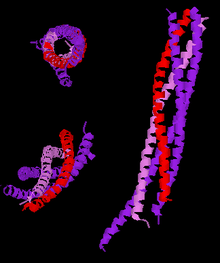 Tres visións distintas da estrutura de alta resolución dun complexo SNARE neuronal truncado. Lenda: sinaptobrevina-2 (vermello), sintaxina-1 (violeta), SNAP-25 (púrpura). | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Synaptobrevin | ||||||||||
| Pfam | PF00957 | ||||||||||
| InterPro | IPR001388 | ||||||||||
| PROSITE | PDOC00368 | ||||||||||
| SCOPe | 1sfc / SUPFAM | ||||||||||
| OPM superfamily | 218 | ||||||||||
| OPM protein | 3dh7 | ||||||||||
| |||||||||||
A sinaptobrevina é unha das proteínas SNARE implicadas na formación de complexos SNARE.
Das catro hélices α do complexo central SNARE unha pertence á sinaptobrevina, outra á sintaxina, e dúas a SNAP-25 (en neuronas).
Función editar
As proteínas SNARE son os compoñentes clave da maquinaria molecular que impulsa a fusión de membranas na exocitose. Porén, a súa función está suxeita a unha fina modulación por varias proteínas reguladoras denominadas mestres SNARE.
Clasificación editar
Na nomenclatura Q/R das proteínas SNARE, os membros da familia VAMP/sinaptobrevina son clasificados como R-SNAREs, denominados así pola presenza dunha arxinina nunha localización específica na secuencia primaria da proteína (e contrapóñense ás SNAREs da membrana diana, que conteñen unha glutamina e denomínanse Q-SNAREs). A sinaptobrevina clasifícase como V-SNARE na nomenclatura V/T, un esquema de clasificación alternativo no cal os SNAREs se clasifican como V-SNAREs e T-SNAREs segundo a súa localización nas vesículas (V) ou nas membranas diana (target, T), respectivamente.[6]
Importancia clínica editar
A sinaptobrevina é degradada pola tetanospasmina, unha proteína derivada da bacteria Clostridium tetani, que causa o tétano. Unha bacteria relacionada, Clostridium botulinum, produce a toxina botúlica que tamén hidroliza a sinaptobrevina.
Proteínas humanas que conteñen ese dominio editar
SEC22A; SEC22B; SYBL1; VAMP1; VAMP2; VAMP3; VAMP4; VAMP5; VAMP8; YKT6;
Notas editar
- ↑ Baumert M, Maycox PR, Navone F, De Camilli P, Jahn R (February 1, 1989). "Synaptobrevin: an integral membrane protein of 18,000 daltons present in small synaptic vesicles of rat brain". EMBO J 8 (2): 379–84. PMC 400817. PMID 2498078.
- ↑ Bock JB, Scheller RH (October 1999). "SNARE proteins mediate lipid bilayer fusion". Proc. Natl. Acad. Sci. U.S.A. 96 (22): 12227–9. PMC 34255. PMID 10535902. doi:10.1073/pnas.96.22.12227.
- ↑ Ernst JA, Brunger AT (2003). "High resolution structure, stability, and synaptotagmin binding of a truncated neuronal SNARE complex". J Biol Chem 278 (10): 8630–6. PMID 12496247. doi:10.1074/jbc.M211889200. Arquivado dende o orixinal o 22 de abril de 2008. Consultado o 12 de agosto de 2015.
- ↑ Fasshauer D, Sutton RB, Brunger AT, Jahn R (December 1998). "Conserved structural features of the synaptic fusion complex: SNARE proteins reclassified as Q- and R-SNAREs". Proc. Natl. Acad. Sci. U.S.A. 95 (26): 15781–6. PMC 28121. PMID 9861047. doi:10.1073/pnas.95.26.15781.
- ↑ Weber T, Zemelman BV, McNew JA, Westermann B, Gmachl M, Parlati F, Sollner TH, Rothman JE (1998). "SNAREpins: minimal machinery for membrane fusion". Cell 92 (6): 759–72. PMID 9529252. doi:10.1016/S0092-8674(00)81404-X.
- ↑ Juan S. Bonifacino and Benjamin S. Glick. "The Mechanisms of Vesicle Budding and Fusion." Cell, Vol. 116, 153–166, January 23, 2004,
Véxase tamén editar
Ligazóns externas editar
- Synaptobrevin Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.