Miristoilación
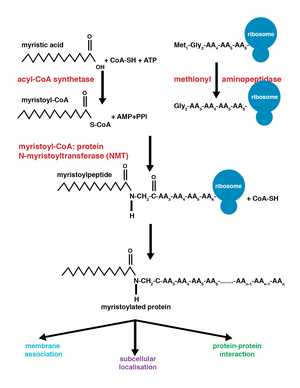
A miristoilación é unha modificación irreversible das proteínas por lipidación consistente na adición por enlace amida covalente dun grupo miristoíl, derivado do ácido mirístico, ao grupo alfa-amino dun residuo de glicina xeralmente do extremo N-terminal da proteína.[1] O ácido mirístico é un ácido graxo saturado de 14 carbonos (14:0). Esta modificación pode realizarse cotraducionalmente (no momento de tradución) ou postraducionalmente (unha vez acabada a tradución). O encima N-miristoiltransferase (NMT) cataliza a reacción de adición do resto de ácido mirístico no citoplasma das células.[2] Esta clase de lipidación é común en moitos tipos de organismos incluíndo animais, plantas, fungos, protozoos [3] e virus. A miristoilación permite interaccións proteína-proteína febles e proteína-lípidos[4] e desempeña unha función esencial en determinar o destino a membranas de proteínas, interaccións proteína-proteína e intervén en varias vías de transdución de sinais.

Descubrimento editar
En 1982, no laboratorio de Koiti Titani identificouse un "grupo bloqueante N-terminal" na subunidade catalítica da proteína quinase dependente do AMP cíclico das vacas como n-tetradecanoíl (residuo de ácido n-tetradecanoico ou ácido mirístico).[5] Case simultaneamente no laboratorio de Claude B. Klee, este mesmo grupo bloqueante N-terminal foi tamén caracterizado como ácido mirístico.[6] Ambos os laboratorios fixeron o descubrimento utilizando técnicas similares: espectrometría de masas con bombardeo con átomos rápidos e cromatografía de gases.[5][6]
N-miristoiltransferase editar
O encima N-miristoiltransferase (NMT) é o responsable da adición irreversible dun grupo miristoíl a residuos de glicina N-terminais ou internos das proteínas. Esta modificación pode producirse cotraducionalmente ou postraducionalmente. Nos vertebrados, esta modificación lévana a cabo dúas NMTs, que se denominan NMT1 e NMT2, ambas as dúas membros da superfamilia das acetiltransferases GCN5.[7]
Estrutura editar
A estrutura cristalina da NMT indica que está formada por dúas subunidades idénticas, cada unha das cales co seu propio sitio de unión para o miristoíl-CoA. Cada subunidade consta dunha grande folla β con forma de escada rodeada de hélices α. O miristoíl-CoA únese á porción N-terminal da proteína, mentres que o extremo C-terminal do encima se une á proteína.[8]
Mecanismo editar
A adición do grupo miristoíl realízase por unha reacción de eliminación nucleofílica. Primeiro, o miristoíl-CoA sitúase no seu peto de unión na NMT de modo que o grupo carbonilo quede en fronte de dous residuos aminoacídicos, que son a fenilalanina 170 e a leucina 171.[8] Isto polariza o carbonilo para que haxa unha carga neta positiva no carbono facéndoo susceptible ao ataque nucleofílico polo residuo de glicina da proteína que vai ser modificada. Cando se une o miristoíl-CoA, a NMT reoriéntase para permitir a unión do péptido. O C-terminal do NMT actúa despois como unha base para desprotonar o NH3+ activando o grupo amino para atacar no carbonilo do miristoíl-CoA. O intermediario tetraédrico resultante estabilízase pola interacción entre un oco oxianión cargado positivamente e o anión alcóxido cargado negativamente. Libérase despois o CoA libre, o que dá lugar a un cambio conformacional no encima, que facilita a liberación do péptido miristoilado.[2]
Adición postraducional e cotraducional editar
As modificacións covalentes cotraducionais e postaducionais que sofren as proteínas permiten que estas desempeñen funcións celulares de alto nivel de complexidade, ademais de engadir diversidade ao proteoma.[9] A adición de miristoíl-CoA á proteína pode ocorrer durante a tradución da proteína ou posteriormente. Durante a adición cotraducional do grupo miristoíl, modifícase a glicina N-terminal despois da clivaxe do residuo de metionina N-terminal no péptido novo en crecemento que se está a formar.[1] Isto ocorre en aproximadamente o 80% das proteínas miristoiladas. A miristoilación postranscricional ocorre tipicamente despois dun evento de clivaxe de caspase, que fai que quede exposto un residuo interno de glicina, o cal despois queda dispoñible para a adición do ácido mirístico.[7]
Funcións editar
Proteínas miristoiladas editar
| Proteína | Función fisiolóxica | Función da miristoilación |
|---|---|---|
| Actina | Proteína estrutural do citoesqueleto | Miristoilación postraducional durante a apoptose [7] |
| Bid | Proteína promotora da apoptose | Miristoilación postraducional despois de que unha clivaxe de caspase destine a proteína á membrana mitocondrial [7] |
| MARCKS | Enlaces cruzados da actina cando é fosforilada por unha proteína quinase C | Miristoilación cotraducional que axuda á asociación coa membrana plasmática |
| Proteína G | Sinalización de GTPase | Miristoilación cotraducional que axuda á asociación coa membrana plasmática[10] |
| Xelsolina | Proteína que corta os filamentos de actina | Miristoilación postraducional que regula á alza as propiedades antiapoptóticas [7] |
| PAK2 | Estimulador de supervivencia, mobilidade e crecemento celular serina/treonina quinase | Miristoilación postraducional que regula á alza as propiedades apoptóticas e induce a localización na membrana plasmática[7] |
| Arf | Tráfico de vesículas e regulación da remodelación de actina | Miristoilación N-terminal que axuda á asociación a membranas |
| Hipocalcina | Sensor de calcio neuronal | Contén un interruptor de Ca2+/miristoíl |
Interruptor molecular de miristoilación editar
A miristoilación non só diversifica a función das proteínas, senón que pode tamén engadir novos niveis de regulación. Unha das funcións principais e máis comúns do grupo miristoíl é determinar a asociación a membranas e a localización celular da proteína modificada. Aínda que o grupo miristoíl se engade ao extremo da proteína, nalgúns casos está secuestrado en rexións hidrofóbicas da proteína en vez de estar exposto ao solvente.[4] Regulando a orientación do grupo miristoíl na proteína, os mencionados procesos celulares poden ser moi coordinados e estreitamente controlados. Esta capacidade fai que se poida definir a miristoiláción como un “interruptor molecular”.[11]
Os interruptores electrostáticos miristoíl caracterízanse por ter un grupo miristoíl hidrofóbico ou ben un “parche básico”, ou rexións con moitas cargas positivas na proteína. O parche básico permite que se produzan interaccións electrostáticas favorables entre as cabezas cargadas negativamente dos fosfolípidos da membrana e a superficie positiva da proteína que se vai asociar á membrana. Isto facilita unha asociación máis forte e dirixe a localización das proteínas.[4]
Os interruptores conformacionais de miristoíl poden ser de varias formas. A unión de ligandos a unha proteína miristoilada que tiña o seu grupo miristoíl secuestrado pode orixinar un cambio conformacional na proteína que faga que quede exposto o grupo miristoíl. De xeito similar, algunhas proteínas miristoiladas non son activadas por un ligando designado, senón polo intercambio de GDP por GTP por factores de intercambio de nucleótidos de guanina (GEFs) da célula. Unha vez que se uniu o GTP á proteína miristoilada, esta queda activada, co grupo miristoíl exposto. Estes interruptores conformacionais poden utilizarse como un sinal para a localización celular, e as interaccións membrana-proteína e proteína-proteína. [4][11][12]
Modificacións duais de proteínas miristoiladas editar
Ulteriores modificacións en proteínas N-miristoiladas poden engadir outro nivel de regulación á proteína. A acilación dual de proteínas pode facilitar unha localización da proteína máis estreitamente regulada, a destinación específica de proteínas a balsas lipídicas das membranas[13] ou permitir a disociación das proteínas miristoiladas das membranas.
A miristoilación e a palmitoilación son xeralmente modificacións que van acopladas. A miristoilación por si soa pode promover interaccións transitorias coa membrana[4] que permiten que a proteína se ancore ás membranas, pero que tamén se poida disociar doadamente. Unha palmitoilación adicional permite unha ancoraxe máis firme e unha disociación máis lenta das membranas cando a célula o precise. Esta modificación dual específica é importante na vías do GPCR e denomínase interruptor de acilación graxa dual.[7]
A miristoilación a miúdo vai seguida dunha fosforilación dos residuos próximos. A fosforilación adicional da mesma proteína pode facer diminuír a afinidade electrostática da proteína miristoilada pola membrana, causando a translocación desa proteína ao citoplasma despois da súa disociación da membrana.[4]
Transdución de sinais editar
A miristoilación xoga un papel vital na destinación a membranas de proteínas e na transdución de sinais[14] na resposta das plantas ao estrés ambiental. Ademais, na transdución de sinais por medio da proteína G, a palmitoilación da subunidade α, a prenilación da subunidade γ, e a miristoilación están implicadas en fixar a proteína G á superficie interna da membrana plasmática para que dita proteína interaccione co seu receptor GPCR.[15]
Apoptose editar
A miristoilación é unha parte integral da apoptose, ou morte celular programada. A apoptose é necesaria para a homeostase da célula e ocorre cando as células están baixo un estrés como a hipoxia ou danos no ADN. A apoptose pode proceder por medio dunha activación mediada por receptor ou por unha activación de orixe mitocondrial. Na apoptose mediada por receptor, as vías apoptóticas actívanse cando a célula se une a un receptor de morte. Nese caso a unión do receptor de morte inicia a formación do complexo de sinalización que induce a morte, que é un complexo composto por moitas proteínas entre as que hai varias caspases, como a caspase 3. A caspase 3 cliva varias proteínas que despois van ser miristoiladas pola NMT. O Bid proapoptótico é unha proteína que, cando é miristoilada, se transloca ás mitocondrias, nas cales provoca a liberación do citocromo c, o que leva á morte da célula.[7] A actina, xelsolina e quinase 2 activada por p21 PAK2 son outras tres proteínas que son miristoiladas despois da súa clivaxe pola caspase 3, que causan unha regulación á alza ou á baixa, segundo os casos, da apoptose.[7]
Saúde humana editar
Cancro editar
O xene c-Src é un xene que é importante para que haxa un ciclo mitótico normal. A proteína que codifica é fosforilada e desfosforilada cambiando a sinalización de "apagado" a "acendido". A proteína c-Src debe estar localizada na membrana plasmática para fosforilar outras dianas situadas augas abaixo; a miristoilación é a responsable deste evento de destinación a membranas. Un incremento da miristoilación da proteína c-Src pode causar un incremento da proliferación celular e pode ser responsable de transformar as células normais en células canceríxenas.[4][12][16] A activación de c-Src pode levar a unha regulación á alza da anxioxénese, da proliferación e da invasión, que son os signos distintivos do cancro.[17]
Infectividade viral editar
O VIH-1 é un retrovirus que depende da miristoilación dunha das súas proteínas estruturais para poder empaquetar o seu xenoma correctamente, ensamblarse e madurar en novas partículas con capacidade infecciosa. É miristoilada a proteína matriz viral, que é o dominio máis N-terminal da poliproteína gag.[18] Esta modificación por miristoilación destina a gag á membrana plasmática da célula hóspede. Utilizando o interruptor electrostático de miristoíl,[11] que inclúe unha zona básica da proteína matriz, a proteína gag pode ensamblarse en balsas lipídicas na membrana plasmática para a ensamblaxe viral, evaxinación e posterior maduración.[16] Para impedir a infectividade viral, podería utilizarse algún fármaco que afectase á miristoilación da proteína matriz.
Infeccións eucarióticas e procarióticas editar
Certas NMTs son dianas terapéuticas para o desenvolvemento de drogas contrra as infeccións bacterianas. A miristoilación é necesaria para a supervivencia de varias bacterias causantes de doenzas infecciosas. Ademais das de bacterias, as NMTs de numerosos organismos eucarióticos causantes de doenzas foron tamén identificados como dianas de fármacos. O correcto funcionamento das NMT nos protozoos Leishmania major e Leishmania donovani (leishmaníase), Trypanosoma brucei (enfermidade do sono africana) e Plasmodium falciparum (malaria) é necesario para a supervivencia destes parasitos. Estase a investigar na obtención de inhibidores para as NMTs destes organismos. Identificouse un inhibidor pirazol sulfonamida que se une selectivamente a NMTs de T. brucei, competindo co sitio de unión ao péptido, que inhibe a actividade encimática e elimina o parasito da corrente sanguínea dos ratos con enfermidade do sono africana.[7]
Notas editar
- ↑ 1,0 1,1 Cox, David L. Nelson, Michael M. (2005). Lehninger principles of biochemistry (4th ed. ed.). New York: W.H. Freeman. ISBN 0716743396.
- ↑ 2,0 2,1 Tamanoi, edited by Fuyuhiko; Sigman, David S. (2001). Protein lipidation (3rd ed. ed.). San Diego, CA: Academic Press. ISBN 978-0-12-122722-7.
- ↑ Kara, UA; Stenzel, DJ; Ingram, LT; Bushell, GR; Lopez, JA; Kidson, C (Apr 1988). "Inhibitory monoclonal antibody against a (myristylated) small-molecular-weight antigen from Plasmodium falciparum associated with the parasitophorous vacuole membrane.". Infection and immunity 56 (4): 903–9. PMID 3278984.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 Farazi, T. A. (29 August 2001). "The Biology and Enzymology of Protein N-Myristoylation". Journal of Biological Chemistry 276 (43): 39501–39504. doi:10.1074/jbc.R100042200.
- ↑ 5,0 5,1 Carr, SA; Biemann, K; Shoji, S; Parmelee, DC; Titani, K (Oct 1982). "n-Tetradecanoyl is the NH2-terminal blocking group of the catalytic subunit of cyclic AMP-dependent protein kinase from bovine cardiac muscle.". Proceedings of the National Academy of Sciences of the United States of America 79 (20): 6128–31. PMID 6959104. doi:10.1073/pnas.79.20.6128.
- ↑ 6,0 6,1 Aitken, A; Cohen, P; Santikarn, S; Williams, DH; Calder, AG; Smith, A; Klee, CB (Dec 27, 1982). "Identification of the NH2-terminal blocking group of calcineurin B as myristic acid.". FEBS letters 150 (2): 314–8. PMID 7160476. doi:10.1016/0014-5793(82)80759-x.
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 Martin, Dale D.O.; Beauchamp, Erwan; Berthiaume, Luc G. (January 2011). "Post-translational myristoylation: Fat matters in cellular life and death". Biochimie 93 (1): 18–31. doi:10.1016/j.biochi.2010.10.018.
- ↑ 8,0 8,1 Bhatnagar, RS; Fütterer, K; Waksman, G; Gordon, JI (Nov 23, 1999). "The structure of myristoyl-CoA:protein N-myristoyltransferase.". Biochimica et biophysica acta 1441 (2-3): 162–72. PMID 10570244. doi:10.1016/s1388-1981(99)00155-9.
- ↑ Snider, Jared. "Overview of Post-Translational Modifications (PTMs)". Thermo Scientific.
- ↑ Chen, Katherine A.; Manning, David R. (2001). "Regulation of G proteins by covalent modification". Oncogene (en inglés) 20: 1643–1652.
- ↑ 11,0 11,1 11,2 McLaughlin, Stuart; Aderem, Alan (July 1995). "The myristoyl-electrostatic switch: a modulator of reversible protein-membrane interactions". Trends in Biochemical Sciences 20 (7): 272–276. doi:10.1016/S0968-0004(00)89042-8.
- ↑ 12,0 12,1 Wright, Megan H.; Heal, William P.; Mann, David J.; Tate, Edward W. (7 November 2009). "Protein myristoylation in health and disease". Journal of Chemical Biology 3 (1): 19–35. doi:10.1007/s12154-009-0032-8.
- ↑ Levental, Ilya; Grzybek, Michal; Simons, Kai (3 August 2010). "Greasing Their Way: Lipid Modifications Determine Protein Association with Membrane Rafts". Biochemistry 49 (30): 6305–6316. doi:10.1021/bi100882y.
- ↑ HAYASHI, Nobuhiro; TITANI, Koiti (2010). "N-myristoylated proteins, key components in intracellular signal transduction systems enabling rapid and flexible cell responses". Proceedings of the Japan Academy, Series B 86 (5): 494–508. doi:10.2183/pjab.86.494.
- ↑ Wall, Mark A.; Coleman, David E.; Lee, Ethan; Iñiguez-Lluhi, Jorge A.; Posner, Bruce A.; Gilman, Alfred G.; Sprang, Stephen R. (December 1995). "The structure of the G protein heterotrimer Giα1β1γ2". Cell 83 (6): 1047–1058. doi:10.1016/0092-8674(95)90220-1.
- ↑ 16,0 16,1 Shoji, S; Kubota, Y (Feb 1989). "[Function of protein myristoylation in cellular regulation and viral proliferation].". Yakugaku zasshi : Journal of the Pharmaceutical Society of Japan 109 (2): 71–85. PMID 2545855.
- ↑ Hanahan, Douglas; Weinberg, Robert A. (March 2011). "Hallmarks of Cancer: The Next Generation". Cell 144 (5): 646–674. doi:10.1016/j.cell.2011.02.013.
- ↑ Hearps, AC; Jans, DA (Mar 2007). "Regulating the functions of the HIV-1 matrix protein.". AIDS research and human retroviruses 23 (3): 341–6. PMID 17411366. doi:10.1089/aid.2006.0108.