Hibridación in situ
A hibridación in situ (con frecuencia abreviada ISH, do inglés in situ hybridization) é un tipo de hibridación que usa un ADN complementario etiquetado, un ARN ou unha febra de ácido nucleico modificado (é dicir, unha sonda) para localizar unha secuencia de ADN ou ARN específica directamente nunha porción ou corte dun tecido (é dicir in situ) ou, se o tecido é o suficientemente pequeno (por exemplo, sementes de plantas, embrións de Drosophila), no tecido completo (hibridación in situ de preparación completa), en células e en células tumorais circulantes (CTCs). Isto é diferente do que se fai en inmunohistoquímica, na que xeralmente se localizan as proteínas en cortes de tecidos.


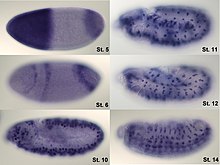
A hibridación in situ utilízase para revelar a localización de secuencias de ácidos nucleicos específicos en cromosomas ou en tecidos, un paso crucial para a comprensión da organización, regulación e funcionamento dos xenes. As técnicas claves actualmente en uso inclúen a hibridación in situ de ARNm con oligonucleótidos e sondas de ARN (tanto radioetiquetadas coma etiquetadas con haptenos), análise con microscopios ópticos e electrónicos, a hibridación in situ de preparación completa, a dobre detección de ARNs e ARN máis proteína, e hibridación fluorescente in situ para detectar secuencias cormosómicas. A hibridación in situ de ADN pode utilizarse para determinar a estrutura dos cromosomas. A hibridación in situ fluorescente de ADN (FISH) pode, por exemplo, utilizarse en diagnósticos médicos para estimar a integridadade cromosómica. A hibridación in situ de ARN utilízase para medir e localizar ARNs (ARNm, ARN non codificante longo, e microARN) en cortes de tecidos, células, preparacións completas, e células tumorais circulantes (CTCs). A hibridación in situ foi inventada por Mary-Lou Pardue e Joseph G. Gall.[1][2][3]
Retos da hibridación in situ editar
A hibridación in situ é unha técnica poderosa para identificar especies de ARNm específicas en células individuais en cortes de tecidos, o que permite estudar procesos fisiolóxicos e a patoxénese de enfermidades. Porén, a hidbridación in situ require que se realicen moitos pasos con gran precisión para cada tecido examinado e para a sonda utilizada. Para preservar o ARNm diana nos tecidos, requírese a miúdo o uso de fixadores de enlaces cruzados como o formaldehido.
Ademais, a hibridación in situ en cortes de tecidos require que as preparacións de tecidos sexan moi finas, xeralmente de 3 µm a 7 µm de grosor. Os métodos comúns para preparar cortes de tecidos para o procesamento por hibridación in situ son cortar os espécimes cun criostato ou un cortador de tecidos Compresstome. Un criostato recolle o tecido fresco ou fixado e mergúllao en nitróxeno líquido para a súa conxelación instantánea. Despois o tecido é incrustado nun medio de conxelación chamado OCT e cótanse láminas finas. Os obstáculos que hai que vencer son a posible obtención de artefactos de conxelación sobre os tecidos que poden interferir coa verdadeira marcaxe do ARNm. O Compresstome corta o tecido en finas láminas sen que haxa un proceso de conxelación; as seccións que quedan flotando libremente córtanse despois de ser incrustadas en agarosa para que teñan máis estabilidade. Como este método evita os tecidos conxelados, non se producen artefactos de conxelación asociados.
Proceso editar
Para a histoquímica de hibridación, usualmente trátanse mostras de células e tecidos para fixar os transcritos diana no seu lugar e para incrementar o acceso á sonda. Como se indicou antes, a sonda é un ADN complementario etiquetado ou, agora máis habitualmente, un ARN complementario (ribosonda). A sonda hibrida coa secuencia diana a elevada temperatura, e despois retírase a sonda en exceso por lavado (despois dunha hidrólise inicial usando a RNase por se hai sondas en exceso non hibridadas). Os parámetros da solución como a temperatura, ou concentración de deterxentes ou sales poden ser manipulados para eliminar calquera interaccións non idénticas (é dicir, só permanecerá unida a secuencia exacta). Despois, a sonda que estaba etiquetada con bases etiquetadas radioactivamente, fluorescentremente ou con antíxenos (por exemplo, a digoxixenina) é localizada e cuantificada no tecido usando autorradiografía, microscopía de fluorescencia ou inmunohistoquímica, respectivamente. Na hibridación in situ poden utilizarse tamén dúas ou máis sondas, etiquetadas con radioactividade ou as outras etiquetas non radioactivas, para detectar simultaneamente dous ou máis transcritos.
Pode utilizarse unha tecnoloxía alternativa, o ensaio de ADN ramificado, para ensaios de hibridación in situ de ARN (ARNm, ARN non codificante longo e microARN) con sensibilidade dunha soa molécula sen o uso de radioactividade. Esta estratexia (por exemplo, ensaios ViewRNA) pode utilizarse para visualizar ata catro dianas nun ensaio e usa sondas patentadas deseñadas e amplificación de sinal de ADN ramificado (bDNA) para xerar sinais sensibles e específicos. Fíxanse as mostras (células, tecidos e CTCs), e despois son tratados para permitir a accesibilidade ao ARN diana (desenmascaramento de ARN). As sondas específicas de diana hibridan con cada ARN diana. Amplifícase o sinal subseguinte da hibridación específica de sondas adxacentes (oligonucleótidos [oligos] específicos que se unen lateralmente sobre os ARN diana). Unha sonda específica de diana conterá 40 oligonucleótidos, o que ten como resultado 20 pares oligo que se unen lateralmente sobre a diana para a detección de ARNm e ARN non codificante longo e 2 oligos ou un só par para a detección de microARN. A amplificación de sinal conséguese por unha serie de pasos de hibridación secuenciais. Unha molécula preamplificadora hibrida con cada par de oligos sobre o ARN específico diana, despois múltiples moléculas amplificadoras hibrídanse con cada preamplificador. Seguidamente, hibrídanse oligonucleótidos sonda multietiquetados (conxugados con fosfatase alcalina ou directamente a fluoróforos) a cada molécula amplificadora. Unha estrutura de amplificación de sinais completamente ensamblada chamada “Tree” ten 400 sitios de unión para as sondas etiquetadas. Cando todas as sondas específicas de diana se unen a transcritos de ARNm diana, ten lugar unha amplificación de sinal de 8000 veces para cada un dos transcritos. Sistemas de amplificación de sinais separados pero compatibles permiten os ensaios múltiples. O sinal pode ser visualizado usando un microscopio de fluorescencia ou de campo brillante.
Pasos básicos para as sondas etiquetadas con digoxixenina editar
- Permeabilización de células con proteinase K para abrir as membranas celulares (dura arredor de 25 minutos, non se necesita para cortes de tecidos ou algúns estadios embrionarios iniciais).
- Unión de ARNm a sondas de ARN marcados (xeralmente durante toda unha noite).
- Unión de anticorpo-fosfatase á sonda de ARN (tarda algunhas horas).
- Marcaxe de anticorpo (por exemplo, con fosfatase alcalina).
O protocolo tarda uns 2–3 días e tárdase certo tempo en facer a instalación. Algunhas compañías venden robots para automatizar o proceso (por exemplo, Intavis InsituPro VSi). Como resultado, realizáronse cribados a grande escala en laboratorios de miles de xenes. Xeralmentre pode accederse aos resultados en páxinas web (ver ligazóns externas).
Notas editar
- ↑ O'Connor, Clare. "Fluorescence In Situ Hybridization (FISH)". Nature Education.
- ↑ Gall, JG; Pardue, ML (June 1969). "Formation and detection of RNA-DNA hybrid molecules in cytological preparations.". Proceedings of the National Academy of Sciences of the United States of America 63 (2): 378–83. PMC 223575. PMID 4895535. doi:10.1073/pnas.63.2.378.
- ↑ Gall, Joe. "Albert Lasker Award for Special Achievement in Medical Science". Lasker Foundation. Arquivado dende o orixinal o 04 de outubro de 2015. Consultado o 10 de marzo de 2019.
Véxase tamén editar
Outros artigos editar
Bibliografía editar
- Jin, L; Lloyd, RV (1997). "In situ hybridization: methods and applications". Journal of Clinical Laboratory Analysis 11 (1): 2–9. PMID 9021518. doi:10.1002/(SICI)1098-2825(1997)11:1<2::AID-JCLA2>3.0.CO;2-F.
- Comprehensive and annotated in situ hybridization histochemistry
- RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis
- The Local Transcriptome in the Synaptic Neuropil Revealed by Deep Sequencing and High-Resolution Imaging
Ligazóns externas editar
- In Situ Hybridization Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- In Situ Hybridization of RNA and miRNA Probes to cells, CTCs, and tissues
- Whole-Mount Hibridación in situ de sondas de ARN a tecidos de plantas
- Preparación de sondas de ADN complexas para FISH 3D con ata seis fluorocromos diferentes
- Hibridación i situ de transcritos de embrións de preparación completa para análise de fenotipos de Drosophila tratada con interferencia de ARN
- Bases de datos in situ: