Canle iónica regulada por voltaxe
As canles iónicas reguladas por voltaxe ou canles iónicas dependentes de voltaxe (en inglés voltage-gated ion channels) son un tipo de proteínas transmembrana que forman canles iónicas que son activadas por cambios no potencial de membrana eléctrico preto da canle. O potencial de membrana altera a conformación das proteínas da canle, regulando a súa apertura e peche. As membranas celulares son xeralmente impermeables aos ións, polo que estes deben difundir a través da membrana por canles proteicas transmembrana. Desempeñan un papel fundamental en células excitables como as neuronas e células musculares, permitindo unha rápida e coordinada despolarización en resposta a un cambio de voltaxe que a desencadea. Estas canles atópanse ao longo do axón e na sinapse e propagan direccionalmente sinais eléctricos. As canles iónicas reguladas por voltaxe adoitan ser específicas de ións, e identificáronse canles específicas para os ións sodio (Na+), potasio (K+), calcio (Ca2+), e cloruro (Cl–).[1] A apertura e peche das canles é desencadeada por cambios na concentración de ións, e, por tanto, gradientes de carga, entre ambos os lados da membrana.[2]
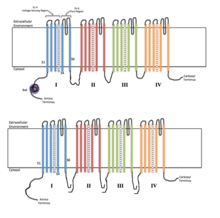 Cada un dos catro dominios homólogos forma unha subunidade da canle iónica. Os segmentos sensibles á voltaxe S4 (marcados con símbolos +) móstranse con carga. | |
| Identificadores | |
|---|---|
| Símbolo | VIC |
| Pfam clan | CL0030 |
| TCDB | 1.A.1 |
| OPM superfamily | 8 |
| OPM protein | 2a79 |

Estrutura editar
As canles iónicas reguladas por voltaxe están xeralmente compostas por varias subunidades arranxadas de tal maneira que hai un poro central a través do cal poden pasar os ións a favor do gradiente electroquímico. As canles adoitan ser específicas de ión, aínda que os ións de similar tamaño e carga poden ás veces pasar tamén a través deles. A funcionalidade das canles iónicas reguladas por voltaxe atribúese ás súas tres subunidades: o sensor de voltaxe, o poro ou vía condutora, e a comporta.[3] As canles de Na+, K+ e Ca2+ están compostas por catro dominios transmembrana dispostos arredor do poro central; estes catro dominios forman parte dunha soa subunidade α no caso da maioría das canles de Na+ e Ca2+, mentres que na maioría das canles de K+ hai catro subunidades α, cada unha das cales contribúe cun dominio transmembrana.[4] Os segmentos que se estenden dun lado a outro da membrana, designados como S1 a S6, teñen todos forma de hélice alfa con funcións especializadas. Os quinto e sexto segmentos transmembrana (S5 e S6) e o bucle do poro desempeña o principal papel na condución de ións, comprendendo a comporta e o poro da canle, mentres que S1-S4 funcionan como rexión sensible á voltaxe.[3] As catro subunidades poden ser idénticas, ou diferentes. Ademais das catro subunidades α centrais, hai tamén subunidades β reguladoras, con actividade de oxidorreductase, que están localizadas na superficie interna da membrana celular e non cruzan a membrana, as cales son coensambladas coas subunidades α no retículo endoplasmático.[5]
Mecanismo editar
Estudos estruturais cristalográficos dunha canle de potasio mostraron que, cando se introduce unha diferenza de potencial na membrana, o campo eléctrico asociado induce un cambio conformacional na canle de potasio. O cambio conformacional distorsiona a forma das proteínas da canle o suficiente para que a cavidade, ou canle, se abra para permitir o influxo ou efluxo a través da membrana. Este movemento de ións a favor das gradientes de concentración xera seguidamente unha corrente eléctrica suficiente para despolarizar a membrana celular.
As canles de sodio e de calcio reguladas por voltaxe están constituídas por un só polipéptido con catro dominios homólogos. Cada dominio contén 6 hélices alfa que abranguen a membrana. Unha destas hélices, a S4, é a hélice sensible á voltaxe.[6] O segmento S4 contén moitas cargas positivas, polo que unha carga positiva alta fóra da célula repele a hélice, mantendo a canle no seu estado pechado.
En xeral, a porción sensible á voltaxe da canle iónica é responsable da detección de cambios no potencial transmembrana que desencadea a apertura ou peche da canle. As hélices alfa S1-4 crese xeralmente que desempeñan este papel. Nas canles de sodio e potasio, as hélices S4 sensibles á voltaxe conteñen residuos de lisina ou arxinina cargados positivamente en motivos repetidos.[3] Na estado de repouso, a metade de cada hélice S4 está en contacto co citosol celular. Coa despolarización, os residuos cargados positivamente nos seus dominios S4 móvense cara á superficie exoplásmica da membrana. Pénsase que as 4 primeiras arxininas explican a creación da corrente de comporta, que se move cara ao solvente extracelular por activación da canle en resposta á despolarización da membrana. O movemento de 10–12 destas cargas positivas unidas a proteína desencadea un cambio conformacional que abre a canle.[4] Non hai acordo sobre cal é o mecanismo exacto polo cal ocorre este movemento; porén, exemplos de teorías actuais son os modelos chamados canónico, de transportador, de pa e retorto.[7]
O movemento do sensor de voltaxe desencadea un cambio conformacional da comporta da vía condutora, controlando o fluxo de ións a través da canle.[3]
A principal parte funcional do dominio proteico sensible á voltaxe destas canles contén xeralmente unha rexión composta das hélices S3b e S4, coñecida como a "pa" ("paddle") debido á súa forma, que parece ser unha secuencia conservada, intercambiable a través dunha gran variedade de células e especies. Unha "pa" sensora de voltaxe similar encontrouse tamén na familia das fosfatases sensibles á voltaxe en varias especies.[8] A substitución por enxeñaría xenética da rexión da pa dunha especie de arquea que habita en zonas volcánicas a canles de potasio de cerebro de rata ten como resultado unha canle iónica completamente funcional, con tal de que se substitúa a "pa" intacta completa.[9] Esta "modularidade" permite o uso de sistemas modelo simples e baratos para estudar a función desta rexión, o seu papel en enfermidades, e o control farmacéutico do seu comportamento en vez de estar limitado a preparacións difíciles de estudar e pouco caracterizadas.[10]
Aínda que as canles iónicas reguladas por voltaxe son activadas normalmente pola despolarización da membrana, algunhas canles, como as canles de ión potasio rectificadora interna son activadas por hiperpolarización.
A comporta crese que está acoplada con rexións sensibles á voltaxe das canles e parece conter unha obstrución mecánica ao fluxo de ións.[11] Aínda que hai acordo sobre que o dominio S6 é o segmento que actúa como dita obstrución, descoñécese o seu mecanismo exacto. Posibles explicacións son: o segmento S6 fai un movemento en tesoira que permite que os ións flúan ao seu través,[12] o segmento S6 sepárase en dous segmentos permitindo o paso dos ións,[13] ou a canle S6 funciona como a propia comporta.[14] O mecanismo polo cal o movemento do segmento S4 afecta a S6 non se coñece; porén, teorizouse que hai un enlazador ou linker S4-S5 cuxo movemento permite a apertura de S6.[3]
A inactivación das canles iónicas ocorre en cuestión de milisegundos despois da súa apertura. A inactivación pénsase que está mediada por unha comporta intracelular que controla a apertura do poro no lado interno da célula.[15] Esta comporta ten a forma dunha bóla unida a unha cadea flexible. Durante a inactivación, a cadea prégase sobre si mesma e a bóla bloquea o fluxo de ións a través da canle.[16] A inactivación rápida está directamente ligada á activación causada por movementos intramembrana dos segmentos S4,[17] aínda que non se sabe cal é o mecanismo do movemento de S4 e a súa relación coa comporta de inactivación.
Tipos editar
Canles de sodio (Na+) editar
As canles de sodio teñen propiedades funcionais similares en moitos tipos celulares. Aínda que se identificaron os xenes humanos que codifican as canles de sodio, as súas funcións están tipicamentre conservadas entre especies e diferentes tipos celulares.[17]
Canles de calcio (Ca2+) editar
Identificaron 16 xenes das canles de calcio humanas, este tipo de canles difiren na súa función nos distintos tipos celulares. As canles de Ca2+ producen potenciais de acción similares ás das canles de Na+ nalgunhas neuronas. Tamén xogan un papel na liberación de neurotransmisores nas terminacións nerviosas presináptica. Na maioría das células, as canles de Ca2+ regulan unha ampla variedade de procesos bioquímicos debido ao seu papel no control das concentracións intracelulares de Ca2+.[13]
Canles de potasio (K+) editar
As canles de potasio son a clase máis grande e máis diversa de canles reguladas por voltaxe, cuns 100 xenes humanos que as codifican. Estes tipos de canles diferéncianse significativamente nas súas propiedades de comporta; algúns deles inactívanse de forma extremadamente lenta e outros extremadamente rápido. Esta diferenza en tempo de activación inflúe na duración e taxa de disparo do potencial de acción, o cal ten un efecto significativo sobre a condución eléctrica ao longo do axón así como na transmisión sináptica. As canles de potasio difiren en estrutura das outras canles porque conteñen catro subunidades polipeptídicas separadas, mentres que outras canles conteñen catro dominios homólogos dun só polipéptido.[7]
Canles de cloruro (Cl−) editar
As canles de cloruro están presentes en todos os tipos de neuronas. A súa principal responsabilidade é controlar a excitabilidade, e as canles de cloruro contribúen ao mantemento do potencial de repouso da célula e axudan a regular o volume celular.[1]
Canles de protóns (H+) editar
As canles de protóns reguladas por voltaxe crean correntes mediadas por ións hidróxeno en forma de hidronio, e son activadas por despolarización de maneira dependente de pH. Funcionan retirando acidez das células.[18][19][20]
Filoxenética editar
Os estudos filoxenéticos de proteínas expresadas en bacterias revelaron a existencia dunha superfamilia de canles de sodio reguladas por voltaxe.[21] Posteriores estudos mostraron que había outras diversas canles iónicas e transportadores que estaban relacionados filoxeneticamente coas canles iónicas reguladas por voltaxe, como as canles de K+ rectificadora interna, as canles de Ca2+ de receptor de ryanodine-inositol 1,4,5-trifosfato, canles de Ca2+ de potencial receptor transitorio, as canles de catións de policistina, as canles iónicas reguladas por glutamato, as canles de cloruro dependentes de calcio, os catión monovalente:protón antiportadores, tipo 1 e os transportadores de potasio.[22]
Notas editar
- ↑ 1,0 1,1 Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia A, McNamara JO, Williams SM (2001). "Voltage-Gated Ion Channels". Neuroscience (2nd ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-742-4.
- ↑ Catterall WA (April 2000). "From ionic currents to molecular mechanisms: the structure and function of voltage-gated sodium channels". Neuron (en inglés) 26 (1): 13–25. PMID 10798388. doi:10.1016/S0896-6273(00)81133-2.
- ↑ 3,0 3,1 3,2 3,3 3,4 Bezanilla F (March 2005). "Voltage-gated ion channels". IEEE Transactions on NanoBioscience 4 (1): 34–48. PMID 15816170. doi:10.1109/tnb.2004.842463.
- ↑ 4,0 4,1 Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Section 21.3, Molecular Properties of Voltage-Gated Ion Channels". Molecular Cell Biology (4th ed.). New York: Scientific American Books. ISBN 978-0-7167-3136-8.
- ↑ Gulbis JM, Mann S, MacKinnon R (June 1999). "Structure of a voltage-dependent K+ channel beta subunit". Cell 97 (7): 943–52. PMID 10399921. doi:10.1016/s0092-8674(00)80805-3.
- ↑ Catterall WA (2010). "Ion channel voltage sensors: structure, function, and pathophysiology". Neuron 67 (6): 915–28. PMC 2950829. PMID 20869590. doi:10.1016/j.neuron.2010.08.021.
- ↑ 7,0 7,1 Sands Z, Grottesi A, Sansom MS (2005). "Voltage-gated ion channels". Current Biology 15 (2): R44–7. PMID 15668152. doi:10.1016/j.cub.2004.12.050.
- ↑ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y (June 2005). "Phosphoinositide phosphatase activity coupled to an intrinsic voltage sensor". Nature 435 (7046): 1239–43. Bibcode:2005Natur.435.1239M. PMID 15902207. doi:10.1038/nature03650.
- ↑ Alabi AA, Bahamonde MI, Jung HJ, Kim JI, Swartz KJ (November 2007). "Portability of paddle motif function and pharmacology in voltage sensors". Nature 450 (7168): 370–5. Bibcode:2007Natur.450..370A. PMC 2709416. PMID 18004375. doi:10.1038/nature06266.
- ↑ Long SB, Tao X, Campbell EB, MacKinnon R (November 2007). "Atomic structure of a voltage-dependent K+ channel in a lipid membrane-like environment". Nature 450 (7168): 376–82. Bibcode:2007Natur.450..376L. PMID 18004376. doi:10.1038/nature06265.
- ↑ Yellen G (August 1998). "The moving parts of voltage-gated ion channels". Quarterly Reviews of Biophysics 31 (3): 239–95. PMID 10384687. doi:10.1017/s0033583598003448.
- ↑ Perozo E, Cortes DM, Cuello LG (July 1999). "Structural rearrangements underlying K+-channel activation gating". Science 285 (5424): 73–8. PMID 10390363. doi:10.1126/science.285.5424.73.
- ↑ 13,0 13,1 Jiang Y, Lee A, Chen J, Cadene M, Chait BT, MacKinnon R (May 2002). "Crystal structure and mechanism of a calcium-gated potassium channel". Nature 417 (6888): 515–22. Bibcode:2002Natur.417..515J. PMID 12037559. doi:10.1038/417515a.
- ↑ Webster SM, Del Camino D, Dekker JP, Yellen G (April 2004). "Intracellular gate opening in Shaker K+ channels defined by high-affinity metal bridges". Nature 428 (6985): 864–8. Bibcode:2004Natur.428..864W. PMID 15103379. doi:10.1038/nature02468.
- ↑ Armstrong CM (July 1981). "Sodium channels and gating currents". Physiological Reviews 61 (3): 644–83. PMID 6265962.
- ↑ Vassilev P, Scheuer T, Catterall WA (October 1989). "Inhibition of inactivation of single sodium channels by a site-directed antibody". Proceedings of the National Academy of Sciences of the United States of America 86 (20): 8147–51. Bibcode:1989PNAS...86.8147V. PMC 298232. PMID 2554301. doi:10.1073/pnas.86.20.8147.
- ↑ 17,0 17,1 Bénitah JP, Chen Z, Balser JR, Tomaselli GF, Marbán E (March 1999). "Molecular dynamics of the sodium channel pore vary with gating: interactions between P-segment motions and inactivation". The Journal of Neuroscience 19 (5): 1577–85. PMID 10024345.
- ↑ Cherny, V.V.; Markin, V.S.; DeCoursey, T.E. (1995). "The voltage-activated hydrogen ion conductance in rat alveolar epithelial cells is determined by the pH gradient" (PDF). Journal of General Physiology (June 1995) 105 (6): 861–896. doi:10.1085/jgp.105.6.861. Consultado o 2008-07-14.
- ↑ DeCoursey, T.E. (2003). "Voltage-gated proton channels and other proton transfer pathways". Physiological Reviews 83 (2): 475–579. OCLC 205658168. PMID 12663866. doi:10.1152/physrev.00028.2002. Consultado o 2008-07-14.
- ↑ Ramsey, I. Scott; Mokrab, Younes; Carvacho, Ingrid; Sands, Zara A.; Sansom, Mark S.P.; Clapham, David E. (2010). "An aqueous H+ permeation pathway in the voltage-gated proton channel Hv1". Nature Structural & Molecular Biology 17 (7): 869–875. PMC 4035905. PMID 20543828. doi:10.1038/nsmb.1826.
- ↑ Koishi R, Xu H, Ren D, Navarro B, Spiller BW, Shi Q, Clapham DE (March 2004). "A superfamily of voltage-gated sodium channels in bacteria". The Journal of Biological Chemistry 279 (10): 9532–8. PMID 14665618. doi:10.1074/jbc.M313100200.
- ↑ Chang, Abraham B.; Lin, Ron; Studley, W. Keith; Tran, Can V.; Saier, Milton H., Jr. (2004). "Phylogeny as a guide to structure and function of membrane transport proteins". Mol Membr Biol 21 (3): 171–181. PMID 15204625. doi:10.1080/09687680410001720830.
Véxase tamén editar
Outros artigos editar
Ligazóns externas editar
- Subunidades de canles iónicas reguladas por voltaxe de IUPHAR-DB Arquivado 18 de xaneiro de 2021 en Wayback Machine.
- Compendio da IUPHAR sobre canles iónicas reguladas por voltaxe 2005 Arquivado 02 de abril de 2018 en Wayback Machine.
- Voltage-Dependent Anion Channels Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.