Plasmodium falciparum
| Plasmodium falciparum | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
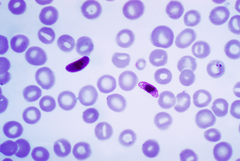 Frotis sanguíneo de Plasmodium falciparum (gametocitos, formas sexuais) | |||||||||||||||||
| Clasificación científica | |||||||||||||||||
| |||||||||||||||||
| Nome binomial | |||||||||||||||||
| 'Plasmodium falciparum' William H. Welch, 1897 | |||||||||||||||||
Plasmodium falciparum é unha especie de protozoos parasitos causante da malaria ou paludismo en humanos, xunto con outras especies do xénero Plasmodium. Transmíteo a femia do mosquito do xénero Anopheles. A malaria causada por esta especie (tamén chamada malaria maligna[1] ou falciparum[2]) é a forma máis perigosa de malaria,[3] e coas maiores taxas de complicacións e mortalidade. En 2006, houbo uns 247 millóns de casos de infeccións de malaria humana (98% en África, 70% entre a poboación de 5 anos ou menos).[4] A súa prevalencia é maior na África subsahariana ca en calquera outra rexión do mundo; na maioría dos países africanos un 75% dos casos de malaria débense ao P. falciparum, mentres que na maioría dos demais países nos que se dá a malaria, predominan outros plasmodios menos virulentos. Case todas as mortes por malaria son causadas por P. falciparum.[4]
Introdución editar
A malaria está causada por unha infección por protozoos do xénero Plasmodium. O nome malaria, do italiano mala aria (mal aire), procede da vinculación suxerida por Giovanni Maria Lancisi (1717) entre a malaria e os vapores velenosos das pantanos. O nome da especie vén do latín falx (fouce), e parere (parir). O microorganismo foi visto por primeira vez por Charles Louis Alphonse Laveran en 1880 no hospital militar de Constantina (Alxeria), e tratábase dun microgametocito en exflaxelación do plasmodio. Patrick Manson (1894) presentou a hipótese de que os mosquitos podían transmitir a malaria. Esta hipótese foi confirmada independentemente por Giovanni Battista Grassi e Ronald Ross en 1898. Grassi (1900) propuxo un estadio exoeritrocítico no ciclo de vida, confirmado posteriormente por Short, Garnham, Covell e Shute (1948), que encontrou Plasmodium vivax no fígado humano.
No mundo, a malaria é a enfermidade parasitaria máis significativa dos humanos, e cóbrase cada ano a vida de máis nenos ca calquera outra enfermidade infecciosa. Desde 1900, a área do mundo exposta á malaria reduciuse á metade, pero aínda así actualmente están expostas a ela 2.000 millóns de persoas. A morbilidade e a mortalidade é substancial. As taxas de infección en nenos nas áreas endémicas é da orde do 50%. A redución na incidencia da malaria coincide cun incremento da produción económica.[5]
Non existen vacinas efectivas contra ningunha das seis ou máis especies de plasmodios causantes da malaria humana, mais os medicamentos contra ela lévanse empregando desde hai séculos. En 1640, Huan del Vego utilizou por primeira vez a tintura de codia de Cinchona (árbore da quinina) para tratar a malaria; os indios nativos do Perú e Ecuador levábana usando desde moito antes para tratar as febres. Pouco despois foi introducida en Europa. Richard Morton (1696) presentou a primeira descrición detallada do cadro clínico da malaria e do seu tratamento con quinina. Gize (1816) estudou a extracción de quinina cristalizada da codia de Cinchona, e Pierre Joseph Pelletier e Joseph Bienaimé Caventou (1820) en Francia extraeron os alcaloides de quinina puros, aos que lle deron os nomes de quinina e cinchonina.
Ciclo de vida de Plasmodium editar
O ciclo de vida de todos as especies de Plasmodium é complexo e pasa por varios estadios, como esporozoíto, merozoíto, esquizonte, gametocito, microgameto, oocineto e ooquiste (vídeo do ciclo de vida).
No fígado editar
A infección en humanos empeza coa picada da femia do mosquito Anopheles. Das glándulas salivares do insecto libérase o esporozoíto do protozoo, que entra na corrente sanguínea cando o insecto inxecta saliva para chuchar sangue, e invade rapidamente as células do fígado (hepatocitos), de modo que os esporozoítos desaparecen da circulación en 30 minutos. Durante os seguintes 14 días no caso de P. falciparum, os parasitos do estadio hepático diferéncianse e sofren multiplicación asexual, orixinando decenas de miles de merozoítos, que saen do hepatocito.
Nos eritrocitos editar
Os merozoítos invaden os glóbulos vermellos (eritrocitos) do sangue humano, orixinan trofozoítos con forma de anel e despois sofren unha rolda adicional de multiplicación, orixinando un esquizonte, que produce de 12 a 16 merozoítos. A duración deste estadio eritrocítico do ciclo de vida do parasito depende da especie de parasito considerada: un ciclo irregular en P. falciparum, 48 horas en P. vivax e P. ovale, e 72 horas en P. malariae.[6] As manifestacións clínicas da malaria, febre e calafríos, están asociadas coa rotura síncrona dos eritrocitos infectados. A liberación dos merozoítos causa a infección de máis eritrocitos. Non todos os merozoítos se dividen en esquizontes, senón que algúns se diferencian en formas sexuais, os gametocitos machos e femias. Estes gametocitos son succionados pola femia do mosquito Anopheles cando se alimenta de sangue.
No insecto editar
Dentro do intestino do insecto, o gametocito macho sofre unha división nuclear rápida, producindo oito microgametos flaxelados, os cales fertilizan aos microgamentos femininos. O resultado é un oocineto, que atravesa a parede intestinal do mosquito e enquístase no exterior da parede intestinal en forma de ooquiste. Pouco despois, o ooquiste rompe, liberando centos de esporozoítos no interior da cavidade corporal do mosquito, desde onde finalmente migran ás glándulas salivares do mosquito, e o ciclo volve a comezar.
Patoxénese editar
Plasmodium falciparum causa malaria grave debido a unha propiedade característica que non presentan outros parasitos da malaria humana, que é o secuestro. Dentro do ciclo do estadio sanguíneo asexual de 48 horas, as formas maduras cambian as propiedades da superficie dos eritrocitos infectados, o que fai que se adhiran á superficie dos vasos sanguíneos, proceso chamado citoadherencia. Isto orixina a obstrución da microcirculación e produce a disfunción de múltiples órganos, como o cerebro na malaria cerebral.[7]
Aparencia microscópica editar
O método preferido polos profesionais da Medicina para diagnosticar a malaria e determinar a especie de Plasmodium causante da infección é o exame microscópico de películas de sangue no laboratorio. Cada especie ten unhas características físicas distintivas que son aparentes vistas co microscopio. En P. falciparum, só se poden ver no sangue periférico os trofozoítos iniciais (forma en anel) e os gametocitos. É raro ver trofozoítos maduros ou esquizontes nos frotis de sangue periférico, xa que normalmente están secuestrados nos tecidos. Os eritrocitos parasitados non están agrandados, e é común ver células con máis dun parasito no seu interior. En certos casos, vense puntos vermellos con forma de coma febles chamados "puntos de Maurer" na superficie do eritrocito. Os puntos con forma de coma poden tamén aparecer como manchas con forma de pera.
Xenoma do Plasmodium falciparum editar
En 1995 creouse o consorcio proxecto xenoma da malaria (MGP) para secuenciar o xenoma de P. falciparum. O seu xenoma mitocondrial publicouse en 1995, e o do seu plastidio non fotosintético (apicoplasto) en 1996,[8] e a secuencia do primeiro cromosoma nuclear (cromosoma 2) en 1998. A secuencia do cromosoma 3 publicouse en 1999, e a do xenoma completo en 2002.[9] Os datos xenómicos anotados poden agora analizarse completamente en varias bases de datos como UCSC Malaria Genome Browser, PlasmoDB and GeneDB. O xenoma de aproximadamente 24 megabases é extremadamente rico en AT (~80%) e está organizado en 14 cromosomas, e foron descritos uns 5.300 xenes.
Influencia de P. falciparum no xenoma humano editar
A presenza do parasito nas poboacións humanas causou unha selección no xenoma humano de diferentes maneiras, xa que os humanos se viron forzados a desenvolver unha resistencia á enfermidade. En 1948 o doutor Beet, suxeriu por primeira vez que a enfermidade das células falciformes (anemia falciforme) podía ofrecer certa protección contra a malaria. Esta suxestión foi reiterada por J. B. S. Haldane en 1949, que coidaba que a talasemia podía proporcionar unha protección similar. Desde entón esta hipótese foi confirmada e estendeuse á hemoglobina C e á hemoglobina E, ás anormalidades na anquirina e a espectrina (ovalocitose, eliptocitose), á deficiencia en glicosa-6-fosfato deshidroxenase e á deficiencia en piruvato quinase, á perda do antíxeno Gerbich (glicoforina C) e do antíxeno Duffy nos eritrocitos, ás talasemias e ás variacións no complexo maior de histocompatibilidade das clases 1 e 2 e no CD32 e CD36.
P. falciparum e a anemia falciforme editar
As persoas con anemia de células falciformes presentan unha parasitemia reducida cando as comparamos cos individuos do tipo salvaxe para a proteína hemoglobina dos eritrocitos. Os estudos mostraron que estas desviacións xenéticas na hemoglobina do estado normal proporcionan protección contra o parasito mortal da malaria [10].
Dos catro parasitos que orixinan malaria, P. falciparum causa a forma máis grave e de maior risco de mortalidade. A malaria é frecuente en países tropicais cunha incidencia de 300 millóns de casos ao ano e unha taxa de mortalidade de 1 a 2 millóns anuais. Aproximadamente o 50% de todas as infeccións por malaria están causadas polo P. falciparum [11]. Despois dunha picada dun mosquito Anopheles infectado, os esporozoítos do plasmodio devastan o corpo humano infectando primeiro o fígado. No fígado os esporozoítos sofren un desenvolvemento asexual e liberan merozoítos á corrente sanguínea. Os trofozoítos desenvólvense máis e reprodúcense invadindo os glóbulos vermellos. Durante o ciclo de reprodución, o Plasmodium falciparum produce ata 40.000 merozoítos nun día. Outros esporozoos do sangue humano como Plasmodium vivax, Plasmodium ovale, e Plasmodium malariae, causan tamén malaria pero non teñen un ciclo de invasión tan produtivo. O proceso de explosión dos eritrocitos ao liberaren o parasito non produce síntomas, pero a destrución das células causa anemia, xa que a medula ósea non pode compensar os grandes danos producidos. Cando rompen os eritrocitos, os residuos de hemocina causan a liberación de citocinas, calafríos, e despois febre[11].
Os trofozoítos de Plasmodium falciparum desenvolven protuberancias pegañentas nos eritrocitos, polas cales despois se adhiren ás células endoteliais dos vasos sanguíneos, e deste modo evitan a súa eliminación no bazo. A natureza adhesiva adquirida polos eritrocitos pode causar malaria cerebral cando as células secuestradas impiden a correcta oxixenación do cerebro. Entre os síntomas da malaria cerebral están as alteracións da conciencia, convulsións, trastornos neurolóxicos, e coma. Outra complicación causada pola malaria inducida por Plasmodium falciparum é a inmunosupresión avanzada [11].
Os individuos co trazo falciforme e anemia falciforme benefícianse de que teñen as protuberancias adherentes alteradas. A parasitemia (a capacidade do parasito de infectar) prodúcese porque os merozoítos dos parasitos que causan a malaria invaden o eritrocito en tres posibles fases: contacto, adhesión e endocitose.[12] Os individuos que sofren de anemia falciforme teñen eritrocitos deformados e esta deformación interfire coa fase de adhesión do parasito e o Plasmodium falciparum e os outros plasmodios da malaria teñen dificultades para realizar a endocitose.
Estes individuos presentan unha reducida adhesión se os comparamos con individuos con hemoglobina normal debido a deferentes interaccións entre proteínas. En circunstancias normais, os merozoítos entran nos eritrocitos por medio dúas interaccións dependentes da proteína PfEMP-1. Estas interaccións promoven unha resposta inflamatoria á malaria asociada cos síntomas de calafríos e febre. Cando estas proteínas están danadas, como nos casos de anemia falciforme, os parasitos non poden experimentar as interaccións de citoadherencia e non poden infectar as células, polo que os individuos con anemia falciforme e os que levan o trazo falciforme teñen menores cargas do parasito e unha duración máis curta dos síntomas do que os individuos con eritrocitos normais.[13].
As persoas con anemia falciforme poden tamén experimentar unha redución notable dos síntomas da malaria porque os trofozoítos de Plasmodium falciparum non poden unirse á hemoglobina para formar protuberancias pegañentas. Sen estes complexos de unión, que son unha característica exclusiva das infeccións por Plasmodium falciparum, os eritrocitos non se adhiren ás paredes endoteliais dos vasos sanguíneos, e as persoas infectadas non experimentan síntomas como a malaria cerebral [12].
A razón de que a selección natural non eliminase a anemia falciforme podería ser que as persoas co trazo falciforme están favorecidas en zonas onde as infeccións por malaria son endémicas[12]. A malaria mata entre 1 e 2 millóns de persoas ao ano. É a principal causa de morte entre os nenos en zonas tropicais. As persoas coa deformación das células falciformes poden loitar contra o plasmodio mellor e non chegan a estar entre as vítimas das mortes por malaria. Xa que logo, os individuos que expresan ou portan os xenes para este trazo son seleccionados favorablemente, e o trazo permanece na poboación [14]. Non debe sorprender, pois, que as rexións onde hai anemia falciforme e as rexións onde hai malaria coincidan.
Vectores coñecidos editar
Son os mosquitos do xénero Anopheles. O principal vector é:
Outros vectores secundarios son:
Orixe e evolución editar
O parente máis próximo de Plasmodium falciparum é Plasmodium reichenowi, que parasita a chimpancés. P. falciparum e P. reichenowi non están moi relacionados coas outras especies de Plasmodium que parasitan a humanos ou a mamíferos en xeral. Propúxose que estas dúas especies se orixinaron a partir de parasitos de aves,[16] pero as análises máis recentes non apoian dita idea, senón que suxiren que a capacidade de parasitar a mamíferos evolucionou soamente unha vez no xénero Plasmodium.[17]
Novas evidencias baseadas na análise de máis de 1.100 secuencias de ADN mitocondrial, do apicoplasto, e dos cromosomas nucleares indican que Plasmodium falciparum puido terse orixinado como especie a partir dunha liñaxe presente nos gorilas.[18][19][20]
Segundo esta teoría, P. falciparum e P. reichenowi poden ambos os dous representar cambios de hóspede do parasito a partir dunha liña ancestral que primitivamente infectaba aos gorilas; P. falciparum pasou a infectar principalmente a humanos e P. reichenowi especializouse en chimpancés. O debate sobre a evolución de Plasmodium falciparum continua actualmente e seguirán a facerse estudos xenéticos.[21]
Descubriuse unha terceira especie que parece estar relacionada coas outras dúas: Plasmodium gaboni. Esta suposta especie coñécese actualmente (ano 2009) só a partir de dúas secuencias de ADN e haberá que agardar a unha descrición completa da especie antes de que esta sexa aceptada como válida.
As análises de reloxos moleculares indican que P. falciparum é tan antigo como a liña evolutiva humana; e que as dúas especies diverxiron ao mesmo tempo ca os humanos e os chimpancés.[22] Porén, os baixos niveis de polimorfismo no xenoma de P. falciparum suxiren unha orixe moito máis recente.[23] Pode ser que exista esta discrepancia porque P. falciparum é antigo, pero a súa poboación sufriu recentemente unha grande expansión.[24] Algunhas evidencias indican que P. reichenowi foi o antepasado de P. falciparum.[25] O momento en que tivo lugar deste evento non está claro actualmente pero propúxose que puido ter ocorrido hai uns 10.000 anos.
Máis recentemente, P. falciparum evolucionou en resposta ás intervencións humanas. A maioría das cepas da malaria poden tratarse con cloroquina, pero P. falciparum desenvolveu resistencia a este tratamento. Tamén se usou unha combinación de quinina e tetraciclina, pero hai cepas de P. falciparum que están a adquirir unha crecente resistencia a este tratamento tamén. Varias cepas de P. falciparum presentan cada vez máis resistencia a diversos tratamentos. Con frecuencia a resistencia da cepa depende da rexión do mundo onde se produciu a infección. Moitos casos de malaria que proceden de partes do Caribe e do oeste do Canal de Panamá ou do Próximo Oriente e Exipto poden a miúdo tratarse con cloroquina, xa que non desenvolveron resistencia. Case todos os casos contraídos en África, India, e sueste asiático adquiriron resistencia a esta medicación e houbo casos en Tailandia e Camboxa nos cales a cepa era resistente a case todos os tratamentos. A miúdo a cepa adquire resistencia a un tratamento en zonas onde o seu uso non está estritamente regulado.
Como moitos Apicomplexa, os parasitos da malaria teñen un plastidio similar ao cloroplasto das plantas, que probablemente adquiriron ao fagocitar (ou ser invadido por) unha alga eucariota, e reter o plastidio da alga como un orgánulo característico envolto en catro membranas (ver endosimbiose). O plastidio dos Apicomplexa, chamado apicoplasto, é un orgánulo esencial para eles, xa que se cre que está implicado na síntese de lípidos e outros varios compostos, e proporciona unha diana atractiva para o desenvolvemento de drogas antimalaricas, especialmente tendo en conta a crecente resistencia á cloroquina e outros axentes antimaláricos existentes.
Vacina editar
Aínda que unha vacina contra a malaria é unha necesidade urxente, os individuos infectados nunca desenvolven unha inmunidade completa esterilizante, o que fai que as perspectivas de obter a vacina sexan escasas. O parasito vive dentro das células, onde está en boa medida agochado da vixilancia do sistema inmunitario. A infección ten un profundo efecto no sistema inmunitario, que inclúe a inmunosupresión. As células dendríticas sofren un defecto de maduración ao interaccionaren con eritrocitos infectados e quedan incapacitadas para inducir unha inmunidade protectora do estadio hepático. Os eritrocitos infectados adhírense directamente e activan a linfocitos B periféricos de doantes non inmunes. Os produtos do xene var, un grupo de antíxenos de superficie expresados profusamente, únense aos fragmentos Fab e Fc das inmunoglobulinas humanas dun modo similar ao da proteína A de Staphylococcus aureus, o cal pode protexer en parte ao parasito da acción do sistema inmunitario humano. Malia as escasas perspectivas dunha vacina que dea unha protección completa, pode ser posible desenvolver unha vacina que reduza significativamente a gravidade da malaria en nenos nas áreas endémicas. Están probándose novas vacinas actualmente.
Notas editar
- ↑ Rich, S. M.; Leendertz, F. H.; Xu, G.; Lebreton, M.; Djoko, C. F.; Aminake, M. N.; Takang, E. E.; Diffo, J. L. D. et al. (2009). "The origin of malignant malaria". Proceedings of the National Academy of Sciences 106 (35): 14902–14907. doi:10.1073/pnas.0907740106. PMC 2720412. PMID 19666593.
- ↑ Perkins, D. J.; Were, T.; Davenport, G. C.; Kempaiah, P.; Hittner, J. B.; Ong'Echa, J. M. (2011). "Severe malarial anemia: Innate immunity and pathogenesis". International journal of biological sciences 7 (9): 1427–1442. PMID 22110393.
- ↑ Perlmann, P; Troye-Blomberg, M (2000). "Malaria blood-stage infection and its control by the immune system". Folia biologica 46 (6): 210–8. PMID 11140853.
- ↑ 4,0 4,1 "World Malaria Report 2008" (PDF). World Health Organisation. 2008. p. 10. Consultado o 2009-08-17.
- ↑ http://www.ijern.com/images/February-2013/13.pdf
- ↑ Biodiversity of the Malaria in the World, Sylvie Manguin et al. Editorial John Libbey, 2008. p. 23
- ↑ Dondorp AM, Pongponratn E, White NJ (2004). "Reduced microcirculatory flow in severe falciparum malaria: pathophysiology and electron-microscopic pathology". Acta Trop. 89 (3): 309–17. PMID 14744557. doi:10.1016/j.actatropica.2003.10.004.
- ↑ Wilson RJ, Denny PW, Preiser PR; et al. (1996). "Complete gene map of the plastid-like DNA of the malaria parasite Plasmodium falciparum". Journal of Molecular Biology 261 (2): 155–72. PMID 8757284. doi:10.1006/jmbi.1996.0449.
- ↑ Gardner MJ, Hall N, Fung E; et al. (2002). "Genome sequence of the human malaria parasite Plasmodium falciparum". Nature 419 (6906): 498–511. PMID 12368864. doi:10.1038/nature01097.
- ↑ Allison AC (February 1954). "Protection Afforded by Sickle-cell Trait Against Subtertian Malarial Infection". Br Med J 1 (4857): 290–4. DOI:10.1136/bmj.1.4857.290. PMC 2093356. PMID 13115700. [1].
- ↑ 11,0 11,1 11,2 Janovy, John; Roberts, Larry S. (2004). Foundations of Parasitology (7th ed.). McGraw-Hill Education (ISE Editions). ISBN 0-07-111271-5.
- ↑ 12,0 12,1 12,2 Cholera R, Brittain NJ, Gillrie MR, et al. (January 2008). "Impaired cytoadherence of Plasmodium falciparum-infected erythrocytes containing sickle hemoglobin". Proc. Natl. Acad. Sci. U.S.A. 105 (3): 991–6. Bibcode 2008PNAS..105..991C. DOI:10.1073/pnas.0711401105. PMC 2242681. PMID 18192399. http://www.pnas.org/cgi/pmidlookup?view=long&pmid=18192399.
- ↑ Mockenhaupt FP, Ehrhardt S, Otchwemah R, et al. (May 2004). "Limited influence of haemoglobin variants on Plasmodium falciparum msp1 and msp2 alleles in symptomatic malaria". Trans. R. Soc. Trop. Med. Hyg. 98 (5): 302–10. DOI:10.1016/j.trstmh.2003.10.001. PMID 15109555. http://linkinghub.elsevier.com/retrieve/pii/S0035920303000890.
- ↑ Allison AC (1964). "Polymorphism and Natural Selection in Human Populations". Cold Spring Harb. Symp. Quant. Biol. 29: 137–49. PMID 14278460.
- ↑ Mbogo CM, Mwangangi JM, Nzovu J; et al. (2003). "Spatial and temporal heterogeneity of Anopheles mosquitoes and Plasmodium falciparum transmission along the Kenyan coast". Am. J. Trop. Med. Hyg. 68 (6): 734–42. PMID 12887036.
- ↑ Rathore, D; Wahl AM, Sullivan M, McCutchan TF (2001-04-25). "A phylogenetic comparison of gene trees constructed from plastid, mitochondrial and genomic DNA of Plasmodium species". Molecular and Biochemical Parasitology 114 (1): 89–94. PMID 11356517. doi:10.1016/S0166-6851(01)00241-9.
- ↑ Yotoko, KSC; C Elisei (2006-11). "Malaria parasites (Apicomplexa, Haematozoea) and their relationships with their hosts: is there an evolutionary cost for the specialization?". Journal of Zoological Systematics and Evolutionary Research 44 (4): 265–73. doi:10.1111/j.1439-0469.2006.00377.x.
- ↑ Liu, W; Y Li, GH Learn, RS Rudicell, JD Robertson, BF Keele, JN Ndjango, CM Sanz, DB Morgan, S Locatelli, MK Gonder, PJ Kranzusch, PD Walsh, E Delaporte, E Mpoudi-Ngole, AV Georgiev, MN Muller, GM Shaw, M Peeters, PM Sharp, JC Rayner, BH Hahn (2010). "Origin of the human malaria parasite Plasmodium falciparum in gorillas". Nature 467 (7314): 420–5. Bibcode:2010Natur.467..420L. PMC 2997044. PMID 20864995. doi:10.1038/nature09442.
- ↑ Duval, L; M Fourment, E Nerrienet, D Rousset, SA Sadeuh, SM Goodman, NV Andriaholinirina, M Randrianarivelojosia, RE Paul, V Robert, FJ Ayala, F Ariey (2010). "African apes as reservoirs of Plasmodium falciparum and the origin and diversification of the Laverania subgenus". Proceedings of the National Academy of Sciences of the United States of America 107 (23): 10561–6. Bibcode:2010PNAS..10710561D. PMC 2890828. PMID 20498054. doi:10.1073/pnas.1005435107.
- ↑ Rayner, J; WM Liu, M Peeters, PM Sharp, BH Hahn (2011). "A plethora of Plasmodium species in wild apes: a source of human infection?". Trends in Parasitology 467 (5): 222. doi:10.1016/J.Pt.2011.01.006.
- ↑ Prugnolle, F; P Durand, B Ollomo, L Duval, F Ariey, C Arnathau, JP Gonzalez, E Leroy, F Renaud (2011). Manchester, Marianne, ed. "A Fresh Look at the Origin of Plasmodium falciparum, the Most Malignant Malaria Agent". PLOS Pathogens 7 (2): e1001283. PMC 3044689. PMID 21383971. doi:10.1371/journal.ppat.1001283.
- ↑ Escalante, AA; E Barrio, FJ Ayala (1995). "Evolutionary origin of human and primate malarias: evidence from the circumsporozoite protein gene". Molecular Biology and Evolution 12 (4): 616–26. ISSN 0737-4038. PMID 7659017.
- ↑ Hartl, DH (2004-01). "The origin of malaria: mixed messages from genetic diversity". Nature Reviews: Microbiology 2 (1): 15–22. PMID 15035005. doi:10.1038/nrmicro795.
- ↑ Joy, DA; Feng X, Mu J, Furuya T, Chotivanich K, Krettli AU, Ho M, Wang A, White NJ, Suh E, Beerli P, Su XZ. (2003-04-11). "Early origin and recent expansion of Plasmodium falciparum". Science 300 (5617): 318–21. Bibcode:2003Sci...300..318J. PMID 12690197. doi:10.1126/science.1081449.
- ↑ Rich SM, Leendertz FH, Xu G, Lebreton M, Djoko CF, Aminake MN, Takang EE, Diffo JL, Pike BL, Rosenthal BM, Formenty P, Boesch C, Ayala FJ, Wolfe ND (2009). "The origin of malignant malaria". Proc Natl Acad Sci USA 106 (35): 14902–7. Bibcode:2009PNAS..10614902R. PMC 2720412. PMID 19666593. doi:10.1073/pnas.0907740106.
Véxase tamén editar
Outros artigos editar
Bibliografía editar
Xeral editar
Distribución editar
Preparacións hematolóxicas editar
- Formas sanguíneas
- Formas sanguíneas
- Formas sanguíneas
- Formas sanguíneas
- Formas sanguíneas múltiples
- Gametocito feminino
- Gametocito feminino
Historias de casos editar
Patoloxía debida a Plasmodium falciparum editar
- Cerebro
- Patoloxía
- Hematoxilina eosina
- Hematoxilina eosina. Adherencia do parasito aos vasos sanguíneos[Ligazón morta]
- Bazo
- Fígado
- Riles
- Low power H & E
- Hematoxilina eosina
- Hematoxilina eosina
- Tinguidura da membrana
- Tinguidura da membrana