Micela
Denomínase micela ao agregado de moléculas surfactantes dispersas nun líquido coloidal, que constitúe unha das fases dos coloides. Os surfactantes son moléculas anfipáticas, é dicir, que teñen unha parte hidrófila e unha parte hidrófoba, e rebaixan a tensión superficial dun líquido.
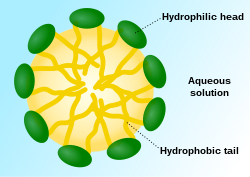


A formación de micelas é o mecanismo polo cal o xabón solubiliza as moléculas insolubles en auga, como as graxas. Na formación dunha micela de xabón en auga, as moléculas de xabón (un sal de sodio ou potasio dun ácido graxo) xúntanse entre si polos seus extremos hidrófobos que corresponden ás cadeas hidrocarbonadas, entanto que os seus extremos hidrófilos, que levan os grupos carboxilo, ionizados negativamente por perda dun ión sodio ou potasio, repélense entre si. Desta maneira as cadeas non polares do xabón non están en contacto coa auga, mentres que os grupos carboxilo, cargados negativamente, están expostos á mesma e poden formar pontes de hidróxeno con ela.
De forma semellante, os lípidos anfipáticos en disolución acuosa diluída emulsiónanse formando micelas. Nas micelas as cadeas hidrocarbonadas se apartan da contorna acuosa e forman unha fase hidrófoba interna, cos grupos hidrófilos expostos na superficie. Estas micelas poden conter miles de moléculas de lípidos e, por tanto, a súa masa é moi elevada.
Durante a dixestión os sales biliares emulsionan formando micelas as graxas dos alimentos, o que facilita a súa absorción intestinal, o que é especialmente importante para lípidos como as lecitinas e vitaminas liposolubles.
Poden orixinarse micelas inversas cando a substancia anfipática se introduce nun disolvente non polar. Nese caso as partes hidrófobas quedan na superficie da micela e as hidrófilas no seu interior. Pero se as cabezas polares teñen unha carga eleéctrica forte poden repelerse facendo inestabe a micela. As micelas inversas teñen no centro hidrófilo unha pequena gota de auga, o que se aproveita en certos experimentos para estudar certas reaccións químicas no ambiente illado do interior desas micelas.
As micelas son aproximadamente esféricas, pero nos coloides poden formarse outras fases con forma elipsoidal, cilíndrica ou bicapas. A forma e tamaño da micela depende da xeometría molecular das moléculas surfactantes e das condicións da disolución, como temperatura, pH ou forza iónica. As micelas mantéñense en constante movemento errático browninao porque as súas cargas fan que se repelan; pero tratándoas con axentes floculantes estas cargas desaparecen e as micelas agréganse e precipitan. A formación de micelas afecta ás propiedades físicas da disolución, como viscosidade, condutividade eléctrica, tensión superficial e presión osmótica.
Enerxía de formación editar
As micelas só se forman cando a concentración do surfactante é maior ca a concentración crítica de micelas, e a temperatura do sistema é maior ca a temperatura crítica de micelas ou temperatura de Krafft. A formación de micelas pode comprenderse usando conceptos termodinámicos: as micelas poden formarse espontaneamente porque hai un equilibrio entre entropía e entalpía. En auga, o efecto hidrófobo é a forza que dirixe a formación de micelas, a pesar de que a ensamblaxe das moléculas surfactantes reduce a súa entropía. A concentracións moi baixas de lípidos, só hai monómeros (sen agregar) en verdadeira disolución. Pero consonte a concentración de lípidos aumenta, chégase a un punto en que as condicións de entropía se fan desfavorables debido a que a influencia das colas hidrófobas das moléculas se fai dominante. Nese punto, as cadeas hidrocarbonadas dunha porción dos lípidos tenden a apartarse do contacto coa auga. Por tanto, o lípido empeza a formar micelas. Grosso modo, por riba da concentración crítica de micelas as condicións entrópicas desfavorables para a ensamblaxe das moléculas de surfactante son menores ca as condicións entrópicas para a solvatación dos monómeros lipídicos con auga. Tamén son importantes as consideracións sobre a entalpía, como as interaccións electrostáticas que ocorren entre as partes cargadas dos surfactantes.
Bibliografía editar
- J. M. Seddon, R. H. Templer. Polymorphism of Lipid-Water Systems, from the Handbook of Biological Physics, Vol. 1, ed. R. Lipowsky, e E. Sackmann. (c) 1995, Elsevier Science B.V. ISBN 0-444-81975-4
- S.A. Baeurle, J. Kroener, Modeling effective interactions of micellar aggregates of ionic surfactants with the Gauss-Core potential, J. Math. Chem. 36, 409–421 (2004).
- McBain, J.W., Trans. Faraday Soc. 1913, 9, 99.
- Hartley, G.S., Aqueous Solutions of Paraffin Chain Salts, A Study in Micelle Formation, 1936, Hermann et Cie, París.
- Makoto Takeo (1999). Disperse Systems, WILEY-VCH, ISBN 3-527-29458-9