Guanidina
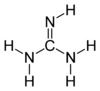
A guanidina é un composto formado a partir da oxidación da guanina, coa fórmula CH5N3, cristalino e moi alcalino, cunha masa de 59,07 d. Non debe confundirse coa base nitroxenada guanina nin co nucleósido guanosina, que teñen nomes parecidos. Aparece de forma natural na urina como un produto normal do metabolismo das proteínas. A súa acumulación no corpo, como en casos de enfermidade renal crónica, está asociada con neurotoxicidade. Úsase na fabricación de plásticos, cauchos e explosivos.
| Guanidina | |
|---|---|

|
|

|
|
Guanidine[1] | |
| Identificadores | |
| Número CAS | 113-00-8 |
| PubChem | 3520 |
| ChemSpider | 3400 |
| UNII | JU58VJ6Y3B |
| Número CE | 204-021-8 |
| DrugBank | DB00536 |
| MeSH | Guanidina |
| ChEBI | CHEBI:42820 |
| ChEMBL | CHEMBL821 |
| Ligando IUPHAR | 4783 |
| Referencia Beilstein | 506044 |
| Referencia Gmelin | 100679 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | CH5N3 |
| Masa molar | 59,07 g mol−1 |
| Punto de fusión | 50 °C; 122 °F; 323 K |
| log P | −1,251 |
| Acidez (pKa) | 13,6 |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
−57–−55 kJ mol−1 |
| Entalpía estándar de combustión ΔcH |
−1,0511–−1,531 MJ mol−1 |
| Perigosidade | |
| LD50 | 475 mg/kg (oral, rata)[2] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
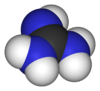
Cando a guanidina se protona, como ocorre a pHs fisiolóxicos, orixina o catión guanidinio [CH6N3]+.
Obtención editar
A molécula sintetizaouse por primeira vez en 1861 por A. Strecker por degradación oxidativa da guanina con cloruro de hidróxeno (HCl) e clorato de potasio, illada do guano do Perú.[3] Pero a súa estrutura cristalina non se detrminou ata 148 anos máis tarde.[4]
Pode obterse tamén por acción do ioduro de amonio sobre a cianamida:
- CN•NH2 + NH4I → CN3H5•HI
Tamén quentando ésteres do ácido orto-carbónico con amoníaco, ou mellor quentando tiocianato de amonio a 180° - 190 °C, temperatura á que a tiourea que primeiro se forma se converte en tiocianato de guanidina.
- 2CS(NH2)2=HN → C(NH2)2•HCNS+H2S .
Catión guanidinio editar
A guanidina está protonada en condicións fisiolóxicas[5], cunha carga de +1, e é unha base moi forte en auga. Este catión é un ácido conxugado da guanidina e recibe o nome de catión guanidinio, [CH6N3]+. Debido á situación do seu dobre enlace forma híbridos de resonancia. O aminoácido arxinina leva no extremo da súa cadea lateral un catión guanidinio.
-
Modelo molecular -
Híbrido de resonancia -
Formas canónicas
Entre os sales importantes deste composto inclúese o hidrocloruro de guanidinio, con propiedades caotrópicas (desestabilización de estruturas tridimensionais de macromoléculas), usado para desnaturalizar proteinas. Empiricamente sábese que este hidrocloruro desnaturaliza as proteínas en relación liñal entre a súa concentración e a enerxía libre de despregamento. Outro sal é o tiocianato de guanidinio.
Derivados da guanidina editar
As guanidinas son un grupo de substancias orgánicas cun grupo funcional común que teñen unha estrutura xeral do tipo (R1R2N)(R3R4N)C=N-R5. O enlace central dentro deste grupo corresponde a unha imina; os outros son aminais. Exemplos de guanidinas son o triazabiciclodeceno e a saxitoxina.
Outros derivados son a arxinina (aminoácido), o hidróxido de guanidinio (ingrediente activo dalgunhas cremas alisadoras de pelo sen lixivia), e o cloruro de guanidinio (desnaturalizador de proteínas).
Uso como combustible alternativo editar
Actualmente está analizándose a posibilidade de utilizar a guanidina como un combustible alternativo. En presenza dun catalizador, un mol de guanidina combínase con 2 moles de auga para dar 3 moles de amoníaco e 1 mol de dióxido de carbono. O amoníaco pódese usar directamente como combustible en motores de combustión interna, ou ser descomposto en nitróxeno e hidróxeno para u seu uso en celas combustible.
A guanidina pódese subministrar pura como un combustible sólido (punto de fusión ~ 50 °C) ou nunha mestura con urea cun punto de fusión eutéctico (da mestura) menor.
Notas editar
- ↑ "Guanidine - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 de setembro de 2004. Identification. Consultado o 29 de febreiro de 2012.
- ↑ http://chem.sis.nlm.nih.gov/chemidplus/rn/50-01-1
- ↑ A. Strecker, Liebigs Ann. Chem. 1861, 118, 151.
- ↑ T. Yamada, X. Liu, U. Englert, H. Yamane, R. Dronskowski, Chem. Eur. J. 2009, 15, 5651.
- ↑ Perrin, D.D., Dissociation Constants of Organic Bases in Aqueous Solution, Butterworths, Londres, 1965; Supplement, 1972.