Complexo adaptador AP2
O complexo adaptador AP2 é unha proteína multimérica que funciona na membrana plasmática internalizando un cargamento por medio de endocitose mediada por clatrina.[1] É un complexo estable de catro adaptinas que dan lugar a unha estrutura que ten un dominio central e dous dominios apéndices unidos ao dominio central por enlazadores polipeptídicos. Estes dominios apéndice chámanse ás veces 'orellas'. O dominio central únese á membrana e ao cargamento destinado para a internalización. Os dominios apéndice alfa e beta únense a proteínas accesorias e á clatrina. As súas interaccións permiten a regulación temporal e espacial da ensamblaxe de vesículas revestidas de clatrina e a súa endocitose.
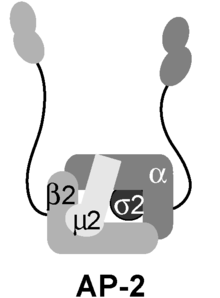
O complexo AP-2 é un heterotetrámero que consta de dúas grandes adaptinas (α e β), unha adaptina mediana (μ) e unha adaptina pequena (σ):
Estrutura editar
O complexo adaptador AP2 pode encontrarse en dúas conformacións primarias: a conformación aberta (estado activo) e a pechada (estado inactivo).[2] No seu estado activo, o sitio de unión da clatrina, que se atopa na subunidade β, e o sitio de unión do cargamento, que se atopa na subunidade μ, están expostos ao citosol,[2] o que permite que ocorran as súas interaccións respectivas. No seu estado inactivo, o complexo experimenta un cambio conformacional que causa que ambos os sitios estean cubertos, impedindo as súas funcións primarias.[3] As cadeas pesadas α e β do complexo constitúen o 60% da secuencia polipeptídica do AP2 e están apertadamente estruturadas en 14 repeticións HEAT que forma estruturas α-helicoidais zigzagueantes que interaccionan coas "patas" helicoidais do trímero de clatrina.[4][2]
Función editar
O AP2 facilita a ensamblaxe de retículas de clatrina cando é necesaria a endocitose, ao agregarse, xunto con outros complexos AP2, na súa conformación activa.[4] Estes agregados de AP2 ineraccionan con proteínas de caltrina polos seus sitios β-activos, orientándoas formando "gaiolas" de clatrina que constitúen o recubrimento endocítico.[4]
Regulación editar
A regulación da actividade do AP2 faise principalmente por rearranxos conformacionais da estrutura en dúas conformacións distintas (e potencialmente unha terceira e unha cuarta conformacións). A conformación "aberta" é o estado activo do complexo, xa que os "pozos" ou sitios de unión activos para as clatrinas e o cargamento están descubertos. Por outra parte, a conformación "pechada" caracterízase polo peche ou inaccesibilidade deses mesmos sitios.[6]
Activación editar
A presenza de clatrinas induce a unión do cargamento, e de xeito similar, a presenza do cargamento parece inducir a unión da clatrina. Isto pénsase que ocorre por unha estabilización secundaria da estrutura do complexo, que permitiría a activación parcial, ou acceso, aos pozos respectivos.[7][8] O fosfatidilinositol (4,5)-bisfosfato (PIP2) funciona como unha secuencia sinal que se une e é recoñecida polo AP2. O PIP2 pode encontrarse dentro dos liposomas que conteñen cargamento, que interacciona co AP2 para que despois se una a clatrina e execute a súa función. Na forma pechada, o sitio de unión do PIP2 está exposto, permitindo que ocora a regulación conformacional.[9] A causa disto, unha serie de lixeiros cambios conformacionais orixina a conformación aberta completa, empezando coa unión do PIP2, despois a unión da secuencia cargamento e finalmente a unión da clatrina.[9] Unha familia de proteínas chamadas muniscinas pénsase que son os activadores alostéricos primarios do complexo adaptador AP,[10] debido á súa prevalencia en pozos asociados ao AP2 e a súa inhibición que ten como resultado na diminución da endocitose mediada polo AP2.[11][12] Adicionalmente, o complexo é regulado e activado pola fosforilación da súa subunidade mu.[13][14]
Desactivación editar
A desactivación ou cambio á conformación "pechada", aínda non está clara. Pénsase que as NECAPs xogan un papel nisto, ao unirse á subunidade α da AP2.[6] Non se sabe moito, pero a conformación aberta do AP2, que está fosforilado, parece ser necesaria para que a NECAP1 se una na súa parte central.[3] O proceso de ación aínda non se coñece, pero esta interacción causa a desfosforilación do complexo adaptador AP2, que dese modo se desactiva.
Importancia médica editar
O AP2 foi identificado para participar intimamente nas vías celulares autofáxicas, responsables da degradación de proteínas agregadas.[15] De feito, forma un complexo coa ensmblaxe fosfatidilinositol-clatrina da leucemia linfoide-mieloide (PICALM), que funcionaría como un importante grupo receptor para a cadea lixeira 3 da proteína asociada aos microtúbulos 1 (LC3). LC3 ten un importante papel nalgunhas vías autofáxicas.[16] A causa disto, sospéitase que a deficiencia ou disfunción de AP2 pode ser precursora do desenvolvemento da enfermidade de Alzheimer familiar.[15]
Notas editar
- ↑ Pearse BM, Smith CJ, Owen DJ (April 2000). "Clathrin coat construction in endocytosis". Current Opinion in Structural Biology 10 (2): 220–228. PMID 10753805. doi:10.1016/S0959-440X(00)00071-3.
- ↑ 2,0 2,1 2,2 Collins BM, McCoy AJ, Kent HM, Evans PR, Owen DJ (2002-05-17). "Molecular Architecture and Functional Model of the Endocytic AP2 Complex". Cell 109 (4): 523–535. doi:10.1016/S0092-8674(02)00735-3.
- ↑ 3,0 3,1 Beacham GM, Partlow EA, Lange JJ, Hollopeter G (xaneiro de 2018). "NECAPs are negative regulators of the AP2 clathrin adaptor complex". eLife 7: e32242. PMC 5785209. PMID 29345618. doi:10.7554/eLife.32242.
- ↑ 4,0 4,1 4,2 Kirchhausen T, Owen D, Harrison SC (maio 2014). "Molecular structure, function, and dynamics of clathrin-mediated membrane traffic". Cold Spring Harbor Perspectives in Biology 6 (5): a016725. PMC 3996469. PMID 24789820. doi:10.1101/cshperspect.a016725.
- ↑ Partlow EA, Baker RW, Beacham GM, Chappie JS, Leschziner AE, Hollopeter G (August 2019). "A structural mechanism for phosphorylation-dependent inactivation of the AP2 complex". eLife 8: e50003. PMC 6739873. PMID 31464684. doi:10.7554/eLife.50003.
- ↑ 6,0 6,1 Beacham GM, Partlow EA, Hollopeter G (outubro de 2019). "Conformational regulation of AP1 and AP2 clathrin adaptor complexes". Traffic 20 (10): 741–751. PMC 6774827. PMID 31313456. doi:10.1111/tra.12677.
- ↑ Ehrlich M, Boll W, Van Oijen A, Hariharan R, Chandran K, Nibert ML, Kirchhausen T (setembro de 2004). "Endocytosis by random initiation and stabilization of clathrin-coated pits". Cell 118 (5): 591–605. PMID 15339664. doi:10.1016/j.cell.2004.08.017.
- ↑ Rapoport I, Miyazaki M, Boll W, Duckworth B, Cantley LC, Shoelson S, Kirchhausen T (maio de 1997). "Regulatory interactions in the recognition of endocytic sorting signals by AP-2 complexes". The EMBO Journal 16 (9): 2240–2250. PMC 1169826. PMID 9171339. doi:10.1093/emboj/16.9.2240.
- ↑ 9,0 9,1 Kadlecova Z, Spielman SJ, Loerke D, Mohanakrishnan A, Reed DK, Schmid SL (xaneiro de 2017). "Regulation of clathrin-mediated endocytosis by hierarchical allosteric activation of AP2". The Journal of Cell Biology 216 (1): 167–179. PMC 5223608. PMID 28003333. doi:10.1083/jcb.201608071.
- ↑ Reider A, Barker SL, Mishra SK, Im YJ, Maldonado-Báez L, Hurley JH, et al. (outubro de 2009). "Syp1 is a conserved endocytic adaptor that contains domains involved in cargo selection and membrane tubulation". The EMBO Journal 28 (20): 3103–3116. PMC 2771086. PMID 19713939. doi:10.1038/emboj.2009.248.
- ↑ Henne WM, Boucrot E, Meinecke M, Evergren E, Vallis Y, Mittal R, McMahon HT (xuño de 2010). "FCHo proteins are nucleators of clathrin-mediated endocytosis". Science 328 (5983): 1281–1284. PMC 2883440. PMID 20448150. doi:10.1126/science.1188462.
- ↑ Cocucci E, Aguet F, Boulant S, Kirchhausen T (August 2012). "The first five seconds in the life of a clathrin-coated pit". Cell 150 (3): 495–507. PMC 3413093. PMID 22863004. doi:10.1016/j.cell.2012.05.047.
- ↑ Ghosh P, Kornfeld S (marzo de 2003). "AP-1 binding to sorting signals and release from clathrin-coated vesicles is regulated by phosphorylation". The Journal of Cell Biology 160 (5): 699–708. PMID 12604586. doi:10.1083/jcb.200211080.
- ↑ Ricotta D, Conner SD, Schmid SL, von Figura K, Honing S (marzo de 2002). "Phosphorylation of the AP2 mu subunit by AAK1 mediates high affinity binding to membrane protein sorting signals". The Journal of Cell Biology 156 (5): 791–795. PMC 2173304. PMID 11877457. doi:10.1083/jcb.200111068.
- ↑ 15,0 15,1 Tian Y, Chang JC, Fan EY, Flajolet M, Greengard P (outubro de 2013). "Adaptor complex AP2/PICALM, through interaction with LC3, targets Alzheimer's APP-CTF for terminal degradation via autophagy". Proceedings of the National Academy of Sciences of the United States of America 110 (42): 17071–17076. PMC 3801056. PMID 24067654. doi:10.1073/pnas.1315110110.
- ↑ Dhingra A, Alexander D, Reyes-Reveles J, Sharp R, Boesze-Battaglia K (2018). "Microtubule-Associated Protein 1 Light Chain 3 (LC3) Isoforms in RPE and Retina". Advances in Experimental Medicine and Biology 1074: 609–616. PMID 29721994. doi:10.1007/978-3-319-75402-4_74.