Acanthamoeba
| Acanthamoeba | |||||||||
|---|---|---|---|---|---|---|---|---|---|
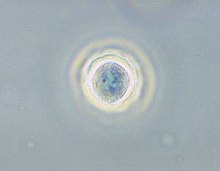 Micrografía de contraste de fase dun quiste de Acanthamoeba polyphaga. | |||||||||
| Clasificación científica | |||||||||
| |||||||||
Acanthamoeba é un xénero de protozoos ameboides, un dos máis comúns no solo, que se encontra frecuentemente tamén en augas doces e outros hábitats. A célula das acantamebas é pequena, xeralmente de 15 a 35 μm de lonxitude e de forma oval a triangular cando se move. Os quistes son comúns. A maioría das especies son de vida libre e aliméntanse de bacterias, pero algunhas son oportunistas e poden causar infeccións en humanos e outros animais.
Patóxeno humano editar
As enfermidades causadas por Acanthamoeba son fundamentalmente a queratite amébica e a encefalite (máis especificamente a encefalite amébica granulomatosa).[1][2] Esta última é causada por Acanthamoeba que entran na boca e se estenden rapidamente ao sistema nervioso central.
Encefalite granulomatosa por Acanthamoeba editar
Acanthamoeba é un protozoo patóxeno oportunista que raramente causa enfermidades nos humanos, pero que ás veces pode orixinar esta encefalite. Informouse aproximadamente duns 400 casos no mundo, cunha taxa de supervivencia de só entre o 2 e o 3%. A infección xeralmente ten lugar en pacientes con inmunodeficiencia[1], diabetes, tumores, malnutrición, lupus eritematoso sistémico, ou alcoholismo. O portal de entrada do parasito son as lesións da pel ou do tracto respiratorio superior ou por inhalación de quistes transportados polo aire. O parasito despois espállase hematoxenamente polo sistema nervioso central. Acanthamoeba cruza a barreira hematoencefálica por un mecanismo aínda descoñecido. A subseguinte invasión do tecido conectivo e a indución de respostas pro-inflamatorias orixinan un dano neuronal que pode ser mortal en poucos días. As biopsias post mortem destes casos mostran graves edemas e necrose hemorráxica.[3] Os pacientes que contraen esta doenza xeralmente presentan síntomas subagudos, como alteracións do seu estado mental, dores de cabeza, febre, rixidez do pescozo, convulsións, signos neurolóxicos focais (como parálises de nervios craniais e coma), todos os cales levan á morte nun período dunha semana a varios meses.[4] Debido á rareza deste parasito e a falta de coñecemento, non existen actualmente bos métodos de diagnose ou tratamentos para a infección por Acanthamoeba.
Tratamento editar
As infeccións por Acanthamoeba xeralmente presentan síntomas que imitan á da leptomeninxite bacteriana, meninxite tuberculosa, ou encefalite viral. Os erros de diagnose a miúdo levan a un tratamento ineficaz. No caso en que a Acanthamoeba se diagnostica correctamente, os tratamentos correctos, como anfotericina-B, rifampicina, trimethroprim-sulfamethoxazole, ketokonazole, fluconazole, sulfadiazine, ou albendazole, son só parcialmente exitosos.
En 2013, publicouse un ensaio in-vitro de medicamentos con Acanthamoeba castellanii que mostraron efectos amebicidas e quisticidas.[5]
Queratite por Acanthamoeba editar
Cando as Acanthamoeba están presentes no ollo poden orixinar queratite acantamébica, o cal pode producir úlceras corneais ou mesmo cegueira. Esta condición aparece con máis frecuencia nos usuarios de lentes de contacto que non as desinfectan debidamente, ou que as manipulan coas mans sucias. As solucións normais para a limpeza de lentes de contacto son bastante ineficaces contra as Acanthamoeba, pero as solucións baseadas no peróxido de hidróxeno son desinfectantes axeitados.[6][7]
Endosimbiontes e virus de Acanthamoeba editar
Especies de Acanthamoeba conteñen diversos endosimbiontes bacterianos, que son similares a patóxenos humanos, polo que foron considerados patóxenos humanos emerxentes potenciais.[8] A natureza exacta destes simbiontes e o beneficio que representan para o hóspede amebiano aínda non foron esclarecidos.
Entre estes patóxenos está a bacteria Legionella e outras similares a Legionella.[9]
Virus editar
As acantamebas son hóspedes de varios virus singulares, como os virus xigantes mimivirus e mamavirus da familia Mimiviridae, atopados en A. polyphaga e A. castellanii. Tamén son infectadas polo virófago Sputnik, que coinfecta cos mamavirus.
MRSA editar
O Staphylococcus aureus resistente á meticilina (SARM ou MRSA) é un importante patóxeno das instalacións hospitalarias debido á súa resistencia a moitos antibióticos. Descubrimentos recentes feitos na Universidade de Bath demostran que o MRSA pode infectar e replicarse dentro das células de Acanthamoeba polyphaga; esta especie é moi común no ambiente. Como A. polyphaga pode formar quistes, os quistes infectados por MRSA poden actuar como forma de dispersión por vía aérea do MRSA.[10] Ademais, as "evidencias que se teñen doutros patóxenos suxiren que os patóxenos que emerxen de amebas son máis resistentes aos antibióticos e máis virulentos."[11] Observouse que Acanthamoeba aumenta a cantidade de MRSA ata 1000 veces.[12] As Acanthamoeba entran no corpo a través da pel ou polo nariz. Despois viaxan polo sistema nervioso ata o cerebro; unha vez alí, aliméntanse de células do cerebro. Despois divídense rapidamente, causando unha rápida e masiva inflamación, que pode matar ao hóspede humano en poucos días.
Acanthamoeba castellanii é sospeitosa de servir como reservorio de bacterias patóxenas como Campylobacter jejuni, que pode causar a síndrome de Guillain–Barré. Informouse da supervivencia de Campylobacter jejuni en cocultivo con Acanthamoeba castellanii.
Importancia na ecoloxía do solo editar
A. castellanii pode atoparse en grandes densidades en varios ecosistemas do solo. Alí, aliméntase de bacterias e tamén de fungos e outros protozoos.
Esta especie pode lisar bacterias e producir un amplo conxunto de encimas, como celulases ou quitinases,[13] e probablemente contribúe á degradación da materia orgánica do solo, contribuíndo ao chamado bucle microbiano (utilización de carbono orgánico disolvido nas augas polas bacterias, que o devolven ás redes tróficas).
Especies editar
As especies de Acanthamoeba distínguense principalmente pola forma dos seus quistes, e entre elas inclúense as seguintes (as marcadas con asterisco causan infeccións):
- A. astronyxis*
- A. castellanii*
- A. comandoni
- A. culbertsoni*
- A. divionensis
- A. griffini
- A. hatchetti*
- A. healyi
- A. jacobsi
- A. keratitis*
- A. lenticulata
- A. lugdunensis*
- A. mauritaniensis
- A. palestinensis*
- A. pearcei
- A. polyphaga*
- A. pustulosa
- A. quina*
- A. rhysodes*
- A. royreba
- A. terricola (renomeada como A. castellanii Poussard)
- A. triangularis
- A. tubiashi
Papel como organismo modelo editar
Como Acanthamoeba non difire moito a nivel ultraestrutural dunha célula de mamífero, é un modelo atractivo para facer estudos biolóxicos. Acanthamoeba é importante en estudos de microbioloxía celular, bioloxía ambiental, fisioloxía, interaccións celulares, bioloxía molecular, bioquímica, e estudos evolutivos, debido ás versátiles funcións deste organismo no ecosistema e a capacidade de capturar presas por fagocitose, actuar como vector e reservorio de microorganismos patóxenos, e producir graves infeccións en humanos. Ademais, Acanthamoeba foi moi utilizada para comprender a bioloxía molecular da motilidade celular.[14]
A cepa Neff de A. castellanii, descuberta nunha lagoa do Parque Golden Gate na década de 1960, debido ao seu cultivo doado e económico, foi moi usada como organismo modelo clásico no eido da bioloxía celular. En 30 litros de medio simple inoculado con A. castellanii, pode obterse aproximadamente un kg de células en poucos días en cultivos aireados a temperatura moderada. En estudos iniciados polo Dr. Edward D. Korn dos NIH descubríronse moitas moléculas biolóxicas importantes e as súas vías metabólicas usando o modelo de Acanthamoeba. O Dr. Thomas Dean Pollard aplicou este modelo nos NIH, Escola de Medicina de Harvard, Escola de Medicina da Universidade Johns Hopkins, e o Instituto Salk de Estudos Biolóxicos para descubrir e caracterizar moitas proteínas que son esenciais para a motilidade celular, non só en amebas, senón tamén en moitas outras células eucarióticas, especialmente as do sistema nervioso humano e sistema inmunitario, o embrión en desenvolvemento, e células cancerosas.
Notas editar
- ↑ 1,0 1,1 Di Gregorio, C; Rivasi F, Mongiardo N, De Rienzo B, Wallace S, Visvesvara GS (1992). "Acanthamoeba meningoencephalitis in a patient with acquired immunodeficiency syndrome". Archives of Pathology & Laboratory Medicine 116 (12): 1363–5. PMID 1456885.
- ↑ Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol Med Microbiol. 2007 Jun;50(1):1-26. PMID 17428307. [1]
- ↑ Khan, N (2006). "Acanthamoeba invasion of the central nervous system". International Journal for Parasitology 37 (2): 131–8. PMID 17207487. doi:10.1016/j.ijpara.2006.11.010.
- ↑ Kaushal, V; Chhina DK, Kumar R, Pannu HS, Dhooria HPS, Chhina RS (2007). "Acanthamoeba Encephalitis". Indian Journal of Medical Microbiology 26 (2): 182–4. PMID 18445961.
- ↑ Abdul Mannan Baig, Junaid Iqbal and Naveed Ahmed Khan. In vitro efficacy of clinically available drugs against growth and viability of Acanthamoeba castellanii keratitis isolate belonging to the T4 genotype. Antimicrobial Agents and Chemotherapyaac.asm.orgPublished ahead of print 13 May 2013, doi: 10.1128/AAC.00299-13 AAC.00299-13. [2] Arquivado 25 de setembro de 2019 en Wayback Machine.
- ↑ Shoff; et al. (2008). "Efficacy of contact lens systems against recent clinical and tap water Acanthamoeba isolates". Cornea 27 (6): 713–9.
- ↑ Johnston; et al. (2009). "Resistance of 'Acanthamoeba Cysts to Disinfection in Multiple Contact Lens Solutions". Journal of Clinical Microbiology: 2040–2045.
- ↑ Horn, M; Wagner, M (2004). "Bacterial Endosymbionts of Free-living Amoebae". Journal of Eukaryotic Microbiology 51 (5): 509–14. PMID 15537084. doi:10.1111/j.1550-7408.2004.tb00278.x.
- ↑ Schuster, F.; Visvesvara, G. (2004). "Opportunistic amoebae: challenges in prophylaxis and treatment". Drug resistance updates : reviews and commentaries in antimicrobial and anticancer chemotherapy 7 (1): 41–51. doi:10.1016/j.drup.2004.01.002. PMID 15072770.
- ↑ Preperation of Acanthamoeba polyphaga and Colpoda steinii inoculum and enumeration. RAMS 3. Applied Sciences SST [3][Ligazón morta]
- ↑ "MRSA use amoeba to spread, sidestepping hospital protection measures, new research shows". University of Bath. 2006-02-28. Arquivado dende o orixinal o 17 de maio de 2013. Consultado o 2007-02-12.
- ↑ "Single Cell Amoeba Increases MRSA Numbers One Thousand Fold". Blackwell Publishing. 2006-03-01. Arquivado dende o orixinal o 12 de marzo de 2007. Consultado o 2007-02-12.
- ↑ Anderson, I. J.; Watkins, R. F., Samuelson, J., Spencer, D. F., Majoros, W. H., Gray, M. W. and Loftus, B. J. (2005). "Gene Discovery in the Acanthamoeba castellanii Genome". Protist 156 (2): 203–14. PMID 16171187. doi:10.1016/j.protis.2005.04.001.
- ↑ Khan N (2009). Acanthamoeba: Biology and Pathogenesis. Caister Academic Press. ISBN 978-1-904455-43-1.
Véxase tamén editar
Outros artigos editar
Ligazóns externas editar
- Acanthamoeba - Centers for Disease Control and Prevention
- Millions of contact lens users are at risk of eye-devouring amoeba
- Vídeo de Acanthamoeba de queratite de lentes de contacto
- Acanthamoeba spp. as Agents of Disease in Humans Arquivado 12 de outubro de 2011 en Wayback Machine. - Clinical Microbiology Reviews, acceso 25 de maio de 2013
- Recursos sobre amebas - imaxes
- Eye health and Acanthamoeba